
【題目】CH4超干重整CO2技術可得到富含CO的化工原料。回答下列問題:
(1)CH4超干重整CO2的催化轉化如圖所示:
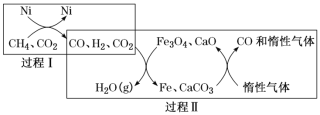
①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ/mol ;
CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165kJ/mol;
過程I的熱化學方程式為_______。
②關于上述過程II的說法不正確的是______(填字母)。
a.實現了含碳物質與含氫物質的分離 b.可表示為CO2+H2H2O(g)+CO c.CO未參與反應 d.Fe3O4、CaO為催化劑,降低了反應的ΔH
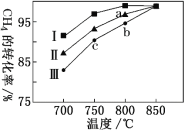
③其他條件不變,在不同催化劑(I、II、III)作用下,反應CH4(g)+CO2(g) 2CO(g)+2H2(g)進行相同時間后,CH4的轉化率隨反應溫度的變化如圖所示。a點是否達到平衡狀態?________(填“是”或“否”);b點CH4的轉化率高于c點,原因是________。
(2)在剛性密閉容器中,加入CH4和CO2,二者分壓分別為20 kPa、25 kPa,加入Ni/α-Al2O3催化劑并加熱至1123 K使其發生反應CH4(g)+CO2(g) 2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.3×10-2·p(CH4) ·p(CO2)。(單位忽略),某時刻測得p(CO)=20 kPa,則p(CO2)=________kPa,v(CO)=________(單位忽略)。
②達到平衡后測得體系壓強是起始時的1.8倍,則該反應的平衡常數的計算式為Kp=________。(用各物質的分壓計算)
【答案】CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1 cd 否 b和c都未達平衡,b點溫度高,反應速率快,相同時間內轉化率高 15 1.95 ![]()
【解析】
根據蓋斯定律,由已知熱化學方程式求出所求熱化學方程式;由題中圖示可知,過程II的反應分兩步,依據各步反應可判斷;根據催化劑只影響化學反應速率,不影響化學平衡移動,則使用不同的催化劑,達平衡時CH4轉化率是一樣的予以判斷;根據化學平衡“三段式”計算CO2的分壓,v(CO),Kp的值。
(1)①由題圖可知,過程I發生CH4+CO2 ![]() 2CO+2H2反應,根據I.CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ/mol ;II.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165kJ/mol;則I×2+II得:CH4(g)+CO2(g)
2CO+2H2反應,根據I.CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ/mol ;II.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165kJ/mol;則I×2+II得:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=2△H1+△H2=2×206.2kJ/mol+(-165kJ/mol)=+247.4kJ/mol;答案為CH4(g)+CO2(g)
2CO(g)+2H2(g) △H=2△H1+△H2=2×206.2kJ/mol+(-165kJ/mol)=+247.4kJ/mol;答案為CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H=+247.4kJ/mol。
2CO(g)+2H2(g) △H=+247.4kJ/mol。
②過程Ⅱ的反應第一步是CO+CO2+H2+Fe3O4+CaO→H2O+Fe+CaCO3,第二步反應:Fe+CaCO3+稀有氣體→稀有氣體+Fe3O4+CaO+CO,
a.上述分析可知,兩步反應實現了含碳物質與含氫物質的分離,故a正確;
b.反應過程中有催化劑(Fe3O4、CaO)和中間產物(Fe、CaCO3),總反應可表示為CO2+H2=H2O (g)+CO,故b正確;
c.CO最后剩余是一氧化碳參與反應過程,最后又生成CO,故c錯誤;
d.Fe3O4、CaO為催化劑,僅改變反應速率不能改變反應的△H,故d錯誤;
答案為cd。
③因為催化劑只改變反應速率不改變平衡移動,所以最終不同催化劑(Ⅰ、Ⅱ、Ⅲ)作用下達平衡時CH4的轉化率相同,故a點所代表的狀態不是平衡狀態,此時反應一直向正反應方向移動,b和c都沒平衡,b點溫度高,反應速率快,相同時間內轉化率高,所以b點CH4的轉化率高于c點;答案為否,b和c都沒平衡,b點溫度高,反應速率快,相同時間內轉化率高。
(2)①在剛性密閉容器中,CH4和CO2的分壓分別為20kPa、25 kPa,加入Ni/α-A12O3催化劑并加熱至 1123K 使其發生反應:某時刻測得p(CO)=20kPa, 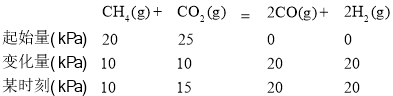 則p(CO2)=15kPa,v(CO)=1.3×10-2·p(CH4) ·p(CO2)= 1.3×10-2×10×15=1.95;答案為15,1.95。
則p(CO2)=15kPa,v(CO)=1.3×10-2·p(CH4) ·p(CO2)= 1.3×10-2×10×15=1.95;答案為15,1.95。
②達到平衡后測得體系壓強是起始時的1.8倍,設達到平衡狀態消耗甲烷分壓x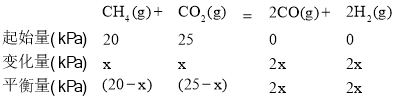 則
則![]() =1.8,解得x=18,則該反應的平衡常數的計算式為Kp=
=1.8,解得x=18,則該反應的平衡常數的計算式為Kp=![]() =
= ![]() =
= ![]() ;答案為
;答案為![]() 。
。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是
A.溴水中存在Br2+H2O![]() HBr+HBrO,當加入硝酸銀溶液后,溶液顏色變淺
HBr+HBrO,當加入硝酸銀溶液后,溶液顏色變淺
B.反應CO(g)+NO2(g) ![]() CO2(g)+NO(g) ΔH<0,平衡后,升高溫度體系顏色變深
CO2(g)+NO(g) ΔH<0,平衡后,升高溫度體系顏色變深
C.用飽和食鹽水除去Cl2中的HCl
D.合成氨反應,為提高氨的產率,可加入適當的催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,向一定體積0.1mol·L-1的氨水中逐滴加入等濃度的鹽酸,溶液中pOH [pOH=-lg c(OH-)]與pH的變化關系如圖所示。下列說法不正確的是
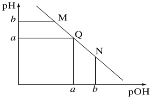
A.M點和N點溶液中H2O的電離程度相同
B.Q點溶液中,c(H+)=c(OH-),pH =7
C.M點溶液的導電性小于Q點溶液的導電性
D.N點溶液加水稀釋,![]() 變小
變小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在人類社會的發展進程中,金屬起著重要的作用。
(1)以下有關金屬單質的敘述正確的是_______。
A.金屬鈉非常活潑,在實驗室中保存在石蠟油或煤油中
B.用坩堝鉗夾住一小塊鋁箔,在酒精燈上加熱,可觀察到鋁箔熔化,并有熔融物滴下
C.鐵單質與水蒸氣反應的化學方程式為2Fe+3H2O(g)=Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三種固體組成的混合物溶于足量水后有1.16 g白色沉淀,在所得的濁液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的體積與生成沉淀的質量關系如下圖所示,試回答:
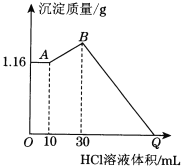
①A點的沉淀物的化學式為________;B點的沉淀物的化學式為________________________;寫出A→B段發生反應的離子方程式_____________________________。
②原混合物中MgCl2的質量是________g,AlCl3的質量是________g,NaOH的質量是________g。
③Q點HCl溶液加入量是________mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】白磷在過量氫氧化鉀溶液中可以發生反應:P4+3KOH+3H2O = PH3↑+3KH2PO2。若用NA表示阿伏加德羅常數的值。下列說法錯誤的是
A.3.1 g白磷所含共價鍵的數目為0.15NA
B.KH2PO2為正鹽,且10.4 g該固體物質中含離子數目為0.2NA
C.2.8 g KOH參加反應轉移的電子數為0.05NA
D.室溫下,10 mL pH=11的KOH溶液稀釋100倍,水電離出的OH-的數目約為10-5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下敘述正確的是( )
5NaCl+NaClO3+3H2O,以下敘述正確的是( )
A.Cl2是氧化劑,NaOH是還原劑
B.被氧化的氯原子和被還原的氯原子的物質的量之比為5∶1
C.Cl2既做氧化劑又做還原劑
D.氧化劑得電子數與還原劑失電子數之比為5∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】密閉容器中發生反應:2X(g)+Y(s)![]() 2Z(g) ΔH<0,達到平衡時,下列說法正確的( )
2Z(g) ΔH<0,達到平衡時,下列說法正確的( )
A.減小容器體積,平衡正向移動B.再加入Z,達平衡時Z的體積分數增大
C.再加入X,X的轉化率減小D.降低溫度,Y的轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】莽草酸的一種異構體A在濃硫酸作用下加熱可得到B.下列說法不正確的是( )
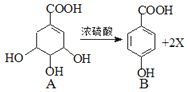
A. X的化學式為H20
B. A既能使![]() 溶液褪色,又能使酸性
溶液褪色,又能使酸性![]() 溶液褪色
溶液褪色
C. B所有碳原子在同一平面上
D. 與B分子式相同,有三個官能團且苯環上的一氯取代物有兩種的異構體只有一種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是 ( )
A.Na與H2O反應:Na+H2O=Na++OH-+H2↑
B.向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
C.向含0.2 mol FeI2的溶液中滴加含0.25 mol Cl2的氯水:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
D.電解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com