
| A. | 碳的燃燒熱110.5 kJ/mol | |
| B. | ①的反應熱為221 kJ/mol | |
| C. | 稀醋酸與稀NaOH溶液反應生成1mol H2O時對應的反應熱為-57.3 kJ/mol | |
| D. | 稀鹽酸與稀NaOH溶液反應生成1mol H2O時對應的反應熱為-57.3 kJ/mol |
分析 A.CO燃燒生成二氧化碳繼續放出熱量;
B.反應熱分吸收熱量,放出熱量;
C.醋酸是弱電解質,電離過程是吸熱;
D.根據中和熱表述方法分析.
解答 解:A.使用燃燒熱時要注意兩個關鍵點:①反應物用量:可燃物為1mol;②產物要求:充分燃燒成穩定氧化物[H→H2O(l)、C→CO2 (g)、S→SO2 (g)],由反應①可知,1mol碳燃燒生成CO放出的熱量為110.5 kJ,CO燃燒生成二氧化碳繼續放出熱量,故1mol碳完全燃燒放出的熱量大于110.5 kJ,所以碳的燃燒熱大于110.5 kJ/mol,故A錯誤;
B.①的反應熱為-221kJ/mol,故B錯誤;
C.醋酸的電離過程是吸熱的,稀醋酸與稀NaOH溶液反應生成1mol水,放出的熱量小于57.3kJ,則反應熱大于-57.3 kJ/mol,故C錯誤;
D.稀鹽酸與稀NaOH溶液反應生成1mol H2O時放出的熱量為57.3kJ,則反應熱為-57.3 kJ/mol,故D正確;
故選D.
點評 本題主要考查學生對于反應熱、中和熱的理解及有關計算等,題目難度不大,注意中和熱表述方法.


科目:高中化學 來源: 題型:選擇題
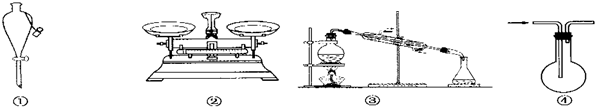
| A. | 儀器①可用于乙醇與水分離提純 | |
| B. | 儀器②可用于稱取5.85 g氯化鈉固體 | |
| C. | 裝置③的燒瓶中應加沸石,以防暴沸 | |
| D. | 裝置④從箭頭方向進氣,用排空氣法可收集H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 配制操作為:稱取8 g NaOH固體,放入100 mL容量瓶中,加入適量蒸餾水,振蕩容量瓶使固體溶解,再加入水到刻度,蓋好瓶塞,反復搖勻 | |
| B. | 稱量 NaOH固體時,應在托盤天平兩盤上各放一張大小相同的紙片 | |
| C. | 若所用NaOH固體中有少量Na2O雜質,則造成所配溶液濃度偏高 | |
| D. | 若用10 mol•L-1NaOH溶液來配制,用量筒量取20 mL NaOH濃溶液倒入燒杯后,應該用同一量筒取一定量蒸餾水倒入燒杯中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 燃燒是將化學能只轉化為熱能 | |
| B. | 濃硫酸溶于水發熱,所以該反應為放熱反應 | |
| C. | 反應物的總能量高于生成物的總能量是放熱反應 | |
| D. | 吸熱反應是斷裂化學鍵吸收的總能量小于形成化學鍵放出的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去AlCl3溶液中的FeCl3雜質的方法:先加入足量濃氨水,過濾,再加入過量鹽酸,得到純凈AlCl3溶液 | |
| B. | 可以用金屬鈉和MgCl2溶液反應置換金屬Mg;可以通過化合反應制備Fe(OH)3 | |
| C. | 對某溶液進行焰色反應,火焰呈黃色,則證明該溶液中含有鈉鹽,可能有鉀鹽 | |
| D. | 配制氯化鐵溶液時,將氯化鐵固體溶解在較濃的鹽酸中再加水稀釋 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 容器編號 | 起始時各物質物質的量/mol | 達平衡時體系能量的變化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出熱量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出熱量:Q |
| A. | 容器①、②中反應的平衡常數相等 | |
| B. | 平衡時,兩個容器中NH3的體積分數均為25% | |
| C. | 容器②中達平衡時放出的熱量Q=23.15 kJ | |
| D. | 若容器①體積為0.5L,則平衡時放出的熱量<23.15kJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com