
【題目】某溫度下,將2molSO2和1molO2置于10L密閉容器中發生反應:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡轉化率(α)與體系總壓強(p)的關系如圖甲所示。則下列說法正確的是( )
2SO3(g);ΔH<0,SO2的平衡轉化率(α)與體系總壓強(p)的關系如圖甲所示。則下列說法正確的是( )
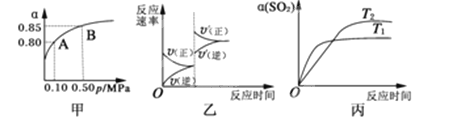
A. 由圖甲推斷,B點SO2的平衡濃度為0.3 mol·L-1
B. 由圖甲推斷,A點對應溫度下該反應的平衡常數為800(L·mol-1)
C. 達平衡后,若增大容器容積,則反應速率變化圖像可以用圖乙表示
D. 壓強為0.50 MPa時不同溫度下SO2轉化率與溫度關系如丙圖,則T2>T1
【答案】B
【解析】試題分析:A.二氧化硫起始濃度為2mol/10L=0.2mol/L,由甲圖可知B點SO2的轉化率為0.85,所以△c(SO2)=0.85×0.2mol/L=0.17mol/L,故二氧化硫的平衡濃度為0.2mol/L-0.17mol/L=0.03mol/L,故A錯誤;B.由甲圖可知A點SO2的轉化率為0.8,所以△c(SO2)=0.8×0.2mol/L=0.16mol/L,則:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
開始(mol/L):0.2 0.1 0
變化(mol/L):0.16 0.08 0.16
平衡(mol/L):0.04 0.02 0.16
所以A點平衡常數為K=![]() =800,故B正確;C.達平衡后,縮小容器容積,反應混合物的濃度都增大,正、逆反應速率都增大,體系壓強增大,平衡向體積減小的反應移動,即平衡向正反應移動,故V(正)>V(逆),可以用圖乙表示,故C錯誤;D.由到達平衡的時間可知,溫度為T1,先到達平衡,反應速率快,溫度越高反應速率越快,故T2<T1,故D錯誤;
=800,故B正確;C.達平衡后,縮小容器容積,反應混合物的濃度都增大,正、逆反應速率都增大,體系壓強增大,平衡向體積減小的反應移動,即平衡向正反應移動,故V(正)>V(逆),可以用圖乙表示,故C錯誤;D.由到達平衡的時間可知,溫度為T1,先到達平衡,反應速率快,溫度越高反應速率越快,故T2<T1,故D錯誤;
故選D。


科目:高中化學 來源: 題型:
【題目】氮的固定對工農業及人類生存具有重大意義。
Ⅰ.合成氨是最重要的人工固氮:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)下列關于該反應的說法中,正確的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S>0 D.△H<0,△S<0
(2) —定溫度下,在容積為1L的密閉容器中,加入ImolN2和3molH2,反應達到平衡時H2的轉化率為60%,則此條件下反應的平衡常數K= (此處不要求寫單位);保持容器體積不變,再向容器中加入lmolN2,3molH2反應達到平衡時,氫氣的轉化率將 (填“增大”、“減小”或“不變”)
(3)標準狀況下,若將22.4mL的氨氣通入100mLpH為2的鹽酸中.則溶液中各離子濃度的順序由大到小為 。
(4)將氨氣通入盛有CaSO4懸濁液的沉淀池中,再通入適量的CO2氣體,充分反應后,過濾所得濾液為(NH4)2SO4溶液,該過程的化學方程式為 。
II.隨著研究的不斷深入,科學家發明了越來越多有關氮的固定方法。
(5)20世紀末,科學家采用高質子導電性的SCY陶瓷(能傳遞H+)為介質,用吸附在它內外表面上的金屬鈀多晶薄膜做電極,實現常壓、570℃高溫的電解法合成氨,提高了反應物的轉化率,其實驗簡圖如下,陰極的電極反應式為 。

(6)近年,又有科學家提出在常溫、常壓、催化劑等條件下合成氨氣的新思路,反應原理為:
2N2(g)+6H2O(I) ![]() 4NH3(g)+3O2(g),則其反應熱△H= 。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),則其反應熱△H= 。(已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g) ![]() 2H2O(I) △H=-571.6kJ·mol-1)
2H2O(I) △H=-571.6kJ·mol-1)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在“綠色化學”工藝中,理想狀態是反應物中的原子全能轉化目標產物,即原子利用率為100%。在下列反應類型中,不能體現這一原子最經濟性原則的是
A. 化合反應 B. 加聚反應 C. 加成反應 D. 消去反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機化合物中,都有多個官能團:

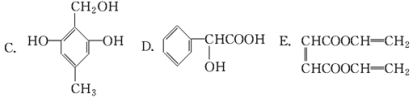
(1)可以看作醇類的是(填入編號,下同)________________。
(2)可以看作酚類的是_________________。
(3)可以看作羧酸類的是_________________。
(4)可以看作酯類的是_________________。
(5)可以看作醛類的是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 精密pH試紙測得某酸溶液的pH為3.5
B. Fe(OH)3膠體和FeSO4溶液均能產生丁達爾效應
C. 容量瓶使用前應檢漏、潤洗
D. 在日常生活中,化學腐蝕是造成鋼鐵腐蝕的主要原因
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用稀鹽酸與稀NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:
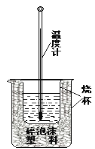
(1)該圖中有兩處未畫出,它們是燒杯上方的泡沫塑料蓋和。泡沫塑料的作用是。
(2)若NaOH溶液用相同濃度和體積的下列溶液代替,則對中和熱數值測定結果將如何影響(填“偏大”、“偏小”、“無影響”):KOH溶液;氨水(NH3·H2O)。
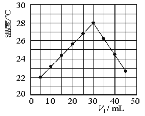
(3)某研究小組將V1mL1.0mol/LHCl溶液和V2mL未知濃度的NaOH溶液混合均勻后測量并記錄溶液溫度,實驗結果如下圖所示(實驗中始終保持V1+V2=50mL)。由題干及圖形可知,V1∶V2=時,酸堿恰好完全中和,此反應所用NaOH溶液的濃度應為mol/L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com