
【題目】實驗室制取氯氣除了用濃鹽酸和二氧化錳反應外還可利用下列反應:KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O,該反應的優點是反應產生氯氣速度快、不需加熱。下圖是實驗室利用此反應制備氯氣并進行一系列相關實驗的裝置(夾持設備已略)。

(1)上述反應中_________是氧化劑,_________是還原劑,若反應中氧化產物比還原產物多1mol,則轉移的電子數目為__________。
(2)裝置B的作用是_____________,實驗進行時C中可能發生堵塞,請寫出發生堵塞時B中的現象:_________________。
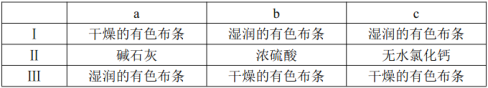
(3)裝置C的實驗目的是驗證氯氣是否具有漂白性,為此C中Ⅰ、Ⅱ、Ⅲ依次放入________(選“a”“b”或“c”)。
(4)設計裝置D、E的目的是為了比較Cl2、Br2、I2的氧化性強弱。已知Br2的水溶液因濃度不同而呈現橙色或紅棕色,I2難溶于水而易溶苯,且I2的苯溶液為紫紅色。當向D中緩緩通入足量Cl2時,可以看到無色溶液逐漸變為紅棕色,說明Cl2的氧化性大于Br2,請寫出D中對應的離子方程式并用雙線橋法表示出電子轉移情況:________________。打開活塞,將D中的少量溶液加入E中,振蕩E,觀察到E中溶液分為兩層,上層(苯層)為紫紅色。該現象___________(填“能”或“不能”)說明Br2的氧化性大于I2。
(5)裝置F的作用是除去污染性的物質(Cl2、Br2等),已知Cl2與NaOH反應時產物中可能有NaCl、NaClO、NaClO3,且c(Cl-)/c(ClO-)的值與溫度高低有關。若燒杯中裝有500mL0.2mol/L的NaOH溶液,則最多可吸收標況下的Cl2的體積為____________L(忽略Cl2溶于水)。
【答案】
(1)KClO3,HCl;2.5NA(寫“2.5mol”不得分)
(2)除雜和安全瓶,錐形瓶中的液面下降,長頸漏斗中的液面上升
(3)c(4)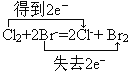 ;不能;(5)1.12
;不能;(5)1.12
【解析】
試題分析:(1)KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O,反應中KClO3中氯元素的化合價由+5價變成0價,HCl中氯元素的化合價由-1價變成0價,因此KClO3是氧化劑,HCl是還原劑,氯氣既是氧化產物又是還原產物,其中氧化產物與還原產物的物質的量之比為5:1,若反應中氧化產物比還原產物多1mol,則生成氯氣的物質的量為1.5mol,轉移的電子數目為2.5NA,故答案為:KClO3,HCl;2.5NA;故答案為:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)鹽酸易揮發,反應制取的氯氣中含有氯化氫,裝置B中飽和食鹽水的作用是除去Cl2中的HCl;裝置B亦是安全瓶,監測實驗進行時C中是否發生堵塞,發生堵塞時B中的,壓強增大,B中長頸漏斗中液面上升,形成水柱,故答案為:除雜和安全瓶;錐形瓶中液面下降,長頸漏斗中液面上升;
(3)裝置C的實驗目的是驗證氯氣是否具有漂白性,要驗證干燥氯氣無漂白性,濕潤的有色布條中,氯氣和水反應生成次氯酸具有漂白性,選項中abc的Ⅱ中都是干燥劑,根據圖示裝置可知,II中應該為固體干燥劑,氯氣干燥后再通入濕潤的有色布條不能驗證氯氣的漂白性,所以C中I、II、III依次放入濕潤的有色布條、無水氯化鈣、干燥的有色布條,所以選c,故答案為:c;
(4)D中對應的離子方程式為Cl2+2Br-=2Cl-+Br2,用雙線橋法表示出電子轉移情況為 ,氯氣具有強氧化性,過量的氯氣能夠將碘離子氧化成碘單質,所以該現象不能說明溴的非金屬性強于碘,故答案為:
,氯氣具有強氧化性,過量的氯氣能夠將碘離子氧化成碘單質,所以該現象不能說明溴的非金屬性強于碘,故答案為: ;不能;
;不能;
(5)根據題意,Cl2與NaOH反應時產物中可能有NaCl、NaClO、NaClO3,無論生成的產物如何,鈉原子與氯原子個數都相等,500mL0.2mol/L的NaOH溶液中含有NaOH的物質的量為0.1mol。根據守恒關系,氯氣的物質的量為0.05mol,標況下的Cl2的體積為0.05mol×22.4L/mol=1.12L,故答案為:1.12;


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】發展“綠色食品”是提高人類生存質量的重要措施,綠色食品指( )
A.綠顏色的營養食品 B.含葉綠素的營養食品
C.植物類營養食品 D.安全無公害的營養食品
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物J具有抗缺血性腦損傷的作用,合成J的一種路線如下:

已知:①
②E的核磁共振氫譜只有一組峰
③C能發生銀鏡反應
回答下列問題:
(1)D所含有官能團的名稱 。
(2)由D生成E的化學方程式為 ,其反應類型為
(3)G的結構簡式為 。
(4)C的某同系物X,相對分子質量比C大14,X的結構有 種,其中核磁共振氫譜為4組峰,且鋒面面積比為1:2:2:2的是 (寫結構簡式)。
(5)由甲醛和化合物A經下列步驟可得到2-苯基乙醇。
![]()
反應條件1為 ;反應條件2所選擇的試劑為 ;L的結構簡式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學為探究二氧化硫的化學性質,設計了如下圖所示的裝置。請回答下列問題。

(1)銅和濃硫酸反應中濃硫酸的作用為______________。
(2)B 瓶中盛有品紅溶液,觀察到品紅溶液褪色,這是因為SO2具有_______,C 瓶中盛有新制的氯水,觀察到氯水褪色,這是因為SO2具有_________。
A.氧化性 B.還原性 C.漂白性
(3)D瓶中盛有足量NaOH溶液以除去SO2,該反應的主要產物的化學式為________。
(4)充分反應后,小組同學發現銅和硫酸都有剩余。若想使剩余的銅片溶解,可再加入____________
A .HNO3 B .NaNO3 C.NaHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰空氣電池比鋰離子電池具有更高的能量密度,前景非常廣闊,其結構及工作原理如下圖(固體電解液只允許Li+通過),下列說法不正確的是

A.電池工作時,正極反應式:O2+2H2O+4e-=4OH-
B.去掉固體電解液和有機電解質:電池反應發生改變
C.充電時,生成14gLi,空氣極質量增加
D.充電時,專用充電極可以有效防止空氣極腐蝕和劣化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組為合成1 一丁醇,查閱資料得知一條合成路線:
CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制備原理:HCOOH![]() CO+H2O,并設計出原料氣的制備裝置(如圖)。
CO+H2O,并設計出原料氣的制備裝置(如圖)。

請填寫下列空白:
(1)實驗室現有鋅粒、稀硝酸、稀鹽酸、濃硫酸、2-丙醇,從中選擇合適的試劑制備丙烯。寫出化學方程式:_______________________。
(2)若用以上裝置制備H2,在虛線框內畫出收集干燥H2的裝置圖。
(3)制丙烯時,還產生少量SO2、CO2及水蒸氣,該小組用以下試劑檢驗這四種氣體,混合氣體通過試劑的順序是_______________(填序號)
① 飽和Na2SO3溶液② 酸性KMnO4溶液③ 石灰水④ 無水CuSO4 ⑤ 品紅溶液
(4)合成正丁醛的反應為正向放熱的可逆反應,為增大反應速率和提高原料氣的轉化率,你認為應該采用的適宜反應條件是_____________。
a.低溫、高壓、催化劑 b.適當的溫度、高壓、催化劑
c.常溫、常壓、催化劑 d.適當的溫度、常壓、催化劑
(5)正丁醛經催化加氫得到含少量正丁醛的1-丁醇粗品,為純化1-丁醇,該小組查閱文獻得知:① RCHO+NaHSO3(飽和)→RCH(OH)SO3Na↓;②沸點:乙醚34℃,1-丁醇118℃,并設計出如下提純路線:

試劑1為_________,操作1為__________,操作2為__________,操作3為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
在實驗室中模擬工業制取NaHCO3的實驗步驟如下:
第一步:連接好裝置,檢驗氣密性,在儀器內裝入藥品。
第二步:先讓某一裝置發生反應,直到產生的氣體不能再在C中溶解,再通入另一裝置中產生的氣體,片刻后,C中出現固體。繼續向C中通入兩種氣體,直到不再有固體產生。
第三步:分離C中所得的混合物,得到NaHCO3固體。
第四步:向濾液中加入適量的某固體粉末,有NH4Cl晶體析出。
(1)下圖所示裝置的連接順序是:a接________;________接_______;b接_________(填接口編號)。

(2)A中常選用的固體反應物為_______________;D中應選用的液體為________________。
(3)第二步中讓___________裝置先發生反應。
(4)C中用球形干燥管而不用直導管,其作用是______________________;裝有無水CaCl2的U形管的作用是_________________________。
(5)第三步分離出NaHCO3固體的操作是________________。
(6)第四步中所加固體粉末化學式為 。所得的晶體中常含有少量的NaCl和NaHCO3(約占5%~8%),請設計一個簡單的實驗,不使用其他任何試劑,證明所得晶體大部分是NH4C1。簡要寫出操作和現象_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.氫氧化鐵膠體的制備步驟如下:
(1)用燒杯取少量蒸餾水,放在酒精燈上加熱至沸騰;
(2)向燒杯中逐滴加入飽和FeCl3溶液;
(3)繼續煮沸至液體是透明的紅褐色,即得Fe(OH)3膠體.
回答下列問題:
①寫出制備Fe(OH)3膠體的化學方程式_____________________;
②如何確定你制備的膠體是否成功?__________________________;
③若向Fe(OH)3膠體中逐滴加入H2SO4溶液會出現的現象:__________________;
II.描述下列反應的現象并寫出反應的離子方程式:
①向NaHCO3溶液中加入NaHSO4溶液,現象______________,離子方程式___________;
②向FeCl3溶液中加入NaOH溶液,現象_______,離子方程式___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com