
分析 (1)發生反應:Zn+2HCl=ZnCl2+H2↑,利用雙線橋表示電子轉移,由反應物指向生成物,表示同種元素之間電子得失情況,并注明電子轉移數目;
(2)根據方程式計算生成氫氣的物質的量,再根據V=nVm計算氫氣的體積;根據方程式計算n(HCl),再利用c=$\frac{n}{V}$計算鹽酸的物質的量濃度;
(3)通過反應方程式可求推出1molZn轉移電子數,計算參加反應的Zn的物質的量進而推出反應中轉移的電子數目.
解答 解:(1)發生反應Zn+2HCl=ZnCl2+H2↑,Zn從0價到+2價化合價升高2價,失去2個電子,電子轉移方向和數目為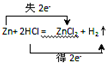 ,
,
故答案為:Zn+2HCl=ZnCl2+H2↑, ;
;
(2)Zn+2HCl=ZnCl2+H2↑
65g 2mol 1mol
6.5g n(Zn) ${n}_{({H}_{2})}$
所以$\frac{65g}{6.5g}$=$\frac{2}{n}$
解得n(Zn)=0.2mol,${n}_{({H}_{2})}$=0.1mol
${V}_{({H}_{2})}$=0.1mol×22.4mol/L=2.24L
C(HCl)=$\frac{0.2mol}{0.2L}$=1mol/L,
答:生成氣體2.24L,鹽酸的物質的量濃度為1mol/L;
(3)6.50g鋅的物質的量為:$\frac{6.5g}{65g/mol}$=0.1mol
由化學方程式Zn+2HCl=ZnCl2+H2↑
1molZn轉移2mol電子,0.1molZn轉移0.2mol電子,N(電子)=0.2mol×6.02×1023mol-1=1.204×1022,
故答案為:1.204×1022.
點評 本題考查根據方程式的計算、常用化學計量的有關計算,比較基礎,注意基礎知識的掌握與根據方程式計算的格式.


科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 鋅是負極,其質量逐漸減小 | B. | 氫離子在銅表面被還原 | ||
| C. | 電子從鋅片經導線流向銅片 | D. | 電流從鋅片經導線流向銅片 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯、乙醇、乙醛 | B. | 乙炔、乙醛、乙二醇 | ||
| C. | 甲醇、甲醚、甲醛 | D. | 乙烷、甘油、乙醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
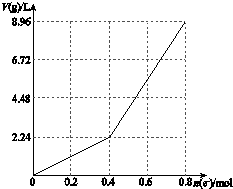 以石墨電極電解200mL CuSO4溶液,電解過程中電子轉移物質的量n(e-)與產生氣體體積V(g)(標準狀況)的關系如圖所示.下列說法中,正確的是( )
以石墨電極電解200mL CuSO4溶液,電解過程中電子轉移物質的量n(e-)與產生氣體體積V(g)(標準狀況)的關系如圖所示.下列說法中,正確的是( )| A. | 電解前CuSO4溶液的物質的量濃度為2 mol/L | |
| B. | 電解后所得溶液中c(H+)=1 mol/L | |
| C. | 當n(e-)=0.6 mol時,V(H2):V(O2)=2:3 | |
| D. | 向電解后的溶液中加入16 g CuO,則溶液可恢復為電解前的濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com