
分析 (1)同溫同壓下,同體積氣體具有相同的分子數;結合二氧化碳、甲烷的分子構成計算原子總數之比;依據ρ=$\frac{M}{Vm}$判斷密度之比;
(2)根據n=$\frac{m}{M}$=$\frac{V}{Vm}$計算物質的量、質量、體積,利用N=n×NA及物質的構成來計算微粒數.
(3)根據n=$\frac{V}{Vm}$計算混合氣體的物質的量,令混合氣體中CO和CO2的物質的量分別為xmol、ymol,根據二者質量之和與物質的量之和列放出計算x、y的值,再根據m=nM計算各自的質量;
依據M=$\frac{m}{n}$計算氣體平均摩爾質量.
解答 解:(1)同溫同壓下,同體積氣體具有相同的分子數,所以在同溫同壓下,同體積的甲烷(CH4)和二氧化碳分子數之比1:1;原子個數之比為:1×5:1×3=5:3;依據ρ=$\frac{M}{Vm}$判斷密度之比,可知在同溫同壓下,同體積的甲烷(CH4)和二氧化碳密度之比為:16:44=4:11;
故答案為:1:1;5:3;4:11;
(2):①氫氣的物質的量為$\frac{4g}{2g/mol}$=2mol,其分子數為2NA,原子數為4NA,質量為4g,標準狀況下的體積為2mol×22.4L/mol=44.8L;
②氧氣的物質的量為$\frac{11.2L}{22.4L/mol}$=0.5mol,其分子數為0.5NA,原子數為NA,質量為0.5mol×32g/mol=16g,標準狀況下的體積為11.2L;
③水的物質的量為1mol,其分子數為NA,原子數為3NA,質量為1mol×18g/mol=18g,標準狀況下水為液體,其體積在三者中最小;
顯然分子數最多的是①,質量最大的是③,體積最小的是③,
故答案為:①;③;③.
(3)混合氣體的物質的量n=$\frac{22.4L}{22.4L/mol}$=1mol;
令混合氣體中CO和CO2的物質的量分別為xmol、ymol,則:x+y=1,28x+44y=40,解得y=0.75,x=0.25,
則m(CO)=0.25mol×28g/mol=7g,m(CO2)=0.75mol×44g/mol=33g,所以二者質量之比為:7:33;
混合氣體的平均摩爾質量是:M=$\frac{40g}{1mol}$=40g/mol;
故答案為:7:33;40g/mol.
點評 本題考查物質的量有關計算,混合物的有關計算、常用化學計量的有關計算,比較基礎,熟悉以物質的量為核心計算公式是解題關鍵,注意對公式的理解與靈活運用.


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:解答題
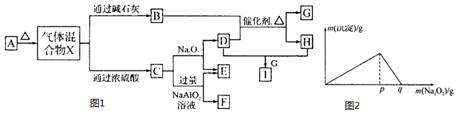
| I溶液的體積(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
| C的體積(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
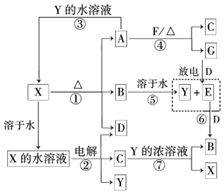 A~G及X、Y均是中學化學常見物質,其中B、D、E、F、G在常溫下為氣體且B為紅棕色,C的硫酸鹽溶液通常為藍色,它們之間有如下轉化關系(其中反應③④⑦的產物中的水已略去).
A~G及X、Y均是中學化學常見物質,其中B、D、E、F、G在常溫下為氣體且B為紅棕色,C的硫酸鹽溶液通常為藍色,它們之間有如下轉化關系(其中反應③④⑦的產物中的水已略去).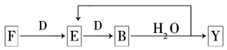
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | MgSO4溶液與Ba(OH)2溶液反應:SO42-+Ba2+═BaSO4↓ | |
| B. | 向澄清的石灰水中加入過量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入過量氨水溶液:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Ca(ClO)2溶液中通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 防止催化劑中毒 | B. | 提高反應效率 | C. | 提高SO2轉化率 | D. | 防止環境污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④⑤ | B. | ③④⑥ | C. | ③④⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com