
【題目】某學習小組通過下列裝置探究MnO2與FeCl36H2O能否反應產生Cl2。
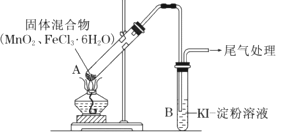
資料:FeCl3是一種共價化合物,熔點306℃,沸點315℃。
ⅰ.實驗操作和現象:
操作 | 現象 |
點燃酒精燈,加熱 | i.A中部分固體溶解,上方出現白霧 ii.稍后,產生黃色氣體,管壁附著黃色液滴 iii.B中溶液變藍 |
ⅱ.分析現象的成因:
(1)現象i中的白霧是______,用化學方程式和必要的文字說明白霧的形成原因是______。
(2)分析現象ii,該小組探究黃色氣體的成分,實驗如下:
a.直接加熱FeCl3·6H2O,產生白霧和黃色氣體。
b.將現象ii和a中的黃色氣體通入KSCN溶液,溶液均變紅。通過該實驗說明現象ii中黃色氣體含有______。
(3)除了氯氣可使B中溶液變藍外,該小組還提出其他兩種可能的原因:
可能原因①:實驗b檢出的氣體使之變藍;
反應的離子方程式是______。
可能原因②:______;
反應的離子方程式是______。
(4)為進一步確認黃色氣體中是否含有Cl2,小組提出兩種方案,均證實了Cl2的存在。
方案1 | 在A、B間增加盛有某種試劑的洗氣瓶C | B中溶液變為藍色 |
方案2 | 將B中KI-淀粉溶液替換為NaBr溶液;檢驗Fe2+ | B中溶液呈淺橙紅色;未檢出Fe2+ |
①方案1的C中盛放的試劑是______,從化學平衡原理的角度加以解釋______。
②方案2中檢驗Fe2+的最佳試劑是______,若存在Fe2+,則現象是______。
③綜合方案1、2的現象,說明方案2中選擇NaBr溶液的依據是______。
(5)將A中產物分離得到Fe2O3和MnCl2,A中產生Cl2的化學方程式是______。
【答案】鹽酸小液滴(或鹽酸酸霧) FeCl3+3H2O![]() Fe(OH)3+3HCl加熱時,水解反應產生HCl,HCl揮發出來遇水蒸氣形成白霧 FeCl3 2Fe3++2I-=I2+2Fe2+ 在酸性條件下,裝置中的空氣使之變藍 4H++4I-+O2=I2+2H2O 飽和食鹽水 Cl2+HO
Fe(OH)3+3HCl加熱時,水解反應產生HCl,HCl揮發出來遇水蒸氣形成白霧 FeCl3 2Fe3++2I-=I2+2Fe2+ 在酸性條件下,裝置中的空氣使之變藍 4H++4I-+O2=I2+2H2O 飽和食鹽水 Cl2+HO![]() HCl+HClO,飽和食鹽水可以吸收HCl和FeCl3且c(Cl-)較大,抑制上述反應 K3[Fe(CN)6](或鐵氰化鉀) 藍色沉淀 氧化性強弱順序Cl2>Br2>Fe3+ 2FeCl3·6H2O+MnO2
HCl+HClO,飽和食鹽水可以吸收HCl和FeCl3且c(Cl-)較大,抑制上述反應 K3[Fe(CN)6](或鐵氰化鉀) 藍色沉淀 氧化性強弱順序Cl2>Br2>Fe3+ 2FeCl3·6H2O+MnO2![]() Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O
Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O
【解析】
(1)FeCl3·6H2O 受熱失去結晶水FeCl3·6H2O![]() FeCl3+6H2O,同時水解FeCl3+3H2O
FeCl3+6H2O,同時水解FeCl3+3H2O![]() Fe(OH)3+3HCl,生成HCl氣體,HCl和H2O結合形成鹽酸小液滴,而形成白霧;
Fe(OH)3+3HCl,生成HCl氣體,HCl和H2O結合形成鹽酸小液滴,而形成白霧;
故答案為:HCl小液滴;FeCl3+3H2O![]() Fe(OH)3+3HCl加熱時,水解反應產生HCl,HCl揮發出來遇水蒸氣形成白霧;
Fe(OH)3+3HCl加熱時,水解反應產生HCl,HCl揮發出來遇水蒸氣形成白霧;
(2)FeCl3溶液中滴入KSCN溶液,發生絡合反應,Fe3++3SCN-=Fe(SCN)3,生成血紅色的硫氰化鐵,用KSCN 溶液檢驗現象ii 和A 中的黃色氣體,溶液均變紅,說明含有FeCl3,
故答案為:FeCl3;
(3)除了氯氣可使B中溶液變藍外,該小組還提出其他兩種可能的原因:可能原因①:實驗b檢出的氣體使之變藍;碘離子具有還原性,氯化鐵具有強氧化性,兩者反應,碘離子被氧化為碘單質,反應的離子方程式是2Fe3++2I-=I2+2Fe2+。
可能原因②:在酸性條件下,裝置中的空氣使之變藍;氧氣將碘離子氧化成碘單質,反應的離子方程式是4H++4I-+O2=I2+2H2O。
故答案為:2Fe3++2I-=I2+2Fe2+;在酸性條件下,裝置中的空氣使之變藍;4H++4I-+O2=I2+2H2O;
(4)①方案1氯化鐵能氧化碘離子,氧氣在酸性條件下,能氧化碘離子,所以需除去Cl2中的FeCl3 和O2(H+),若仍能觀察到B中溶液仍變為藍色,則證明原氣體中確實存在Cl2,在A、B間增加盛有飽和食鹽水的洗氣瓶C,從化學平衡原理的角度加以解釋:Cl2+HO![]() HCl+HClO,飽和食鹽水可以吸收HCl和FeCl3且c(Cl-)較大,抑制上述反應。
HCl+HClO,飽和食鹽水可以吸收HCl和FeCl3且c(Cl-)較大,抑制上述反應。
故答案為:飽和食鹽水;Cl2+HO![]() HCl+HClO,飽和食鹽水可以吸收HCl和FeCl3且c(Cl-)較大,抑制上述反應;
HCl+HClO,飽和食鹽水可以吸收HCl和FeCl3且c(Cl-)較大,抑制上述反應;
②方案2若B中觀察到淺橙紅色,為溴水的顏色,則證明有物質能夠將Br-氧化成Br2,鐵離子不能氧化溴離子,若未檢查到Fe2+,則證明是Cl2氧化的Br-,而不是Fe3+.另外,因為還原劑用的不是I-,可不用考慮O2(H+)的影響問題,即排除Fe3+將Br-氧化成Br2 的可能性;
方案2中檢驗Fe2+的最佳試劑是K3[Fe(CN)6](或鐵氰化鉀)若存在Fe2+,則現象是藍色沉淀。
故答案為:K3[Fe(CN)6](或鐵氰化鉀);藍色沉淀;
③綜合方案1、2的現象,Br-可以被Cl2氧化成Br2,但不會被Fe3+氧化為Br2,方案2中選擇NaBr溶液的依據是氧化性強弱順序Cl2>Br2>Fe3+。
故答案為:氧化性強弱順序Cl2>Br2>Fe3+;
(5)將A中產物分離得到Fe2O3和MnCl2,A中MnO2將氯離子氧化產生Cl2的化學方程式是2FeCl3·6H2O+MnO2![]() Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O。
Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O。
故答案為:2FeCl3·6H2O+MnO2![]() Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O。
Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值。硫化鈉廣泛應用于冶金染料、皮革、電鍍等工業。硫化鈉的一種制備方法是Na2SO4+2C![]() Na2S+2CO2↑。下列說法正確的是
Na2S+2CO2↑。下列說法正確的是
A.4.2g14C原子含中子數目為1.8NA
B.1L0.1mol/LNa2S溶液中含陰離子的數目小于0.1NA
C.該反應中,若生成1mol氧化產物,轉移電子數目為4NA
D.常溫下2.24LCO2中共用電子對數目為0.4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年是元素周期表發表150周年,期間科學家為完善周期表做出了不懈努力。中國科學院院士張青蓮教授曾主持測定了銦(49In)等9種元素相對原子質量的新值,被采用為國際新標準。銦與銣(37Rb)同周期。下列說法不正確的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子數與電子數的差值為17
C. 原子半徑:In>Al
D. 堿性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為減小CO2對環境的影響,在限制其排放量的同時,應加強對CO2創新利用的研究。
(1)①把含有較高濃度CO2的空氣通入飽和K2CO3溶液。②在①的吸收液中通高溫水蒸氣得到高濃度的CO2氣體。請寫出②中反應的化學方程式______。
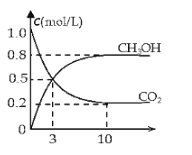
(2)如將CO2與H2以1:3的體積比混合,在適當條件下合成燃料甲醇和水。在體積為2L的密閉容器中,充入2mol CO2和6mol H2,一定條件下發生反應:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0kJ/mol。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示。
從反應開始到平衡,v(H2)=______;氫氣的轉化率=______;能使平衡體系中n(CH3OH)增大的措施有______。(只寫一種即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】精煉銅工業中陽極泥的綜合利用具有重要意義。一種從銅陽極泥(主要含有銅、銀、金、少量的鎳)中分離提取多種金屬元素的工藝流程如圖:
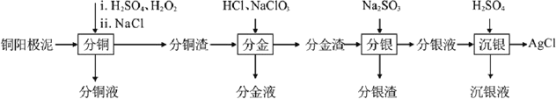
已知:ⅰ分金液中含金離子主要成分為[AuCl4]-;分金渣的主要成分為AgCl;
ⅱ分銀液中含銀離子主要成分為[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
ⅲ“分銅”時各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率/% | 85.7 | 0 | 4.5 | 93.5 |
(1)由表中數據可知,Ni的金屬性比Cu____。分銅渣中銀元素的存在形式為_________(用化學用語表示)。
(2)“分金”時,單質金發生反應的離子方程式為____。
(3)Na2SO3溶液中含硫微粒物質的量分數與pH的關系如圖所示。
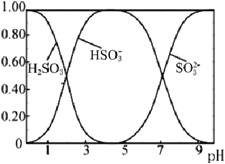
“沉銀”時,需加入硫酸調節溶液的pH=4,分析能夠析出AgCl的原因為__。調節溶液的pH不能過低,理由為__(用離子方程式表示)。
(4)工業上,用鎳為陽極,電解0.1mol/LNiCl2溶液與一定量NH4Cl組成的混合溶液,可得高純度的球形超細鎳粉。當其他條件一定時,NH4Cl的濃度對陰極電流效率及鎳的成粉率的影響如圖所示:
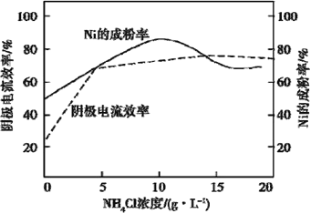
為獲得髙純度的球形超細鎳粉,NH4Cl溶液的濃度最好控制為_____g/L,當NH4Cl溶液的濃度大于15g/L時,陰極有無色無味氣體生成,導致陰極電流效率降低,該氣體為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.  與
與![]() 含有相同的官能團,互為同系物
含有相同的官能團,互為同系物
B. 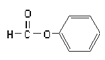 屬于醛類,官能團為-CHO
屬于醛類,官能團為-CHO
C. ![]() 的名稱為:2-乙基-1-丁烯
的名稱為:2-乙基-1-丁烯
D. ![]() 的名稱為:2-甲基-1,3-二丁烯
的名稱為:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某高分子化合物R的結構簡式如圖,下列有關R的說法正確的是
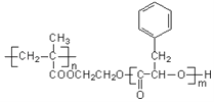
A. R的單體之一的分子式為C9H12O2
B. R可通過加聚和縮聚反應合成,R完全水解后生成2種產物
C. R是一種有特殊香味,難溶于水的物質
D. 堿性條件下,1 mol R完全水解消耗NaOH的物質 的量為n(m+1)mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列依據所給條件推出的結論不正確的是( )
選項 | 條件 | 結論 |
A | 在水溶液中或熔融狀態下可以導電的化合物稱為電解質 | CH3COOH水溶液中存在:CH3COOH |
B | 凡是能給出質子的分子或離子稱為酸,凡是能接受質子的分子或離子稱為堿 | H2O既是酸又是堿 |
C | Fe3Cl8可以改寫為FeCl2·2FeC13 | Fe3I8可以改寫為FeI·2FeI3 |
D | HCl在一定條件下能被MnO2氧化為Cl2 | HBr在一定條件下也能被MnO2氧化為Br2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】國家航天局計劃2020年實施火星探測任務。據了解火星上存在大量的含氮化合物,科學家推測火星生命可能主要以氮、碳、硅、銅為基體構成。
請回答下列問題:
(1)鄰氨基吡啶(![]() )的銅配臺物在有機不對稱合成中起催化誘導效應。
)的銅配臺物在有機不對稱合成中起催化誘導效應。
①鄰氨基吡啶中所有元素的電負性出小到大的順序為__(填元素符號)。設NA為阿伏加德羅常數的值,1mol![]() 中含有σ鍵的數目為__。
中含有σ鍵的數目為__。
②一定條件下-NH2可以被氧化成-NO2,-NO2中N原子的雜化方式為__雜化。
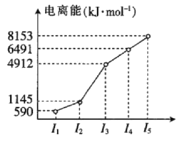
(2)第四周期的某主族元素,其第一至第五電離能數據如圖所示,則該元素的基態原子電子排布式為___。
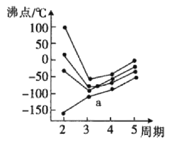
(3)元素周期表中的第IVA族~第VIIA族中部分元素的最簡單氫化物的沸點變化趨勢線如圖,其中一個小黑點代表-種氫化物,則趨勢線a代表第__族元素的最簡單氫化物的沸點變化趨勢,判斷依據是__。
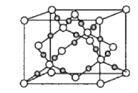
(4)干冰是常見的分子晶體,而CO2在高溫高壓下能形成另一種晶體其晶胞如圖所示,該CO2晶體的熔點__(填“>”“<”或“=”)SiO2晶體的熔點。
(5)一種嘌呤和一種吡啶的結構如圖。
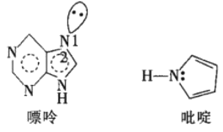
①嘌呤中軌道之間的夾角∠1比∠2大,原因是__。
②分子中的大π鍵可以用符號![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數。則該吡啶中的大π鍵可表示為__。
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數。則該吡啶中的大π鍵可表示為__。
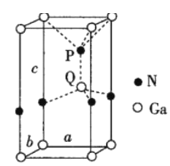
(6)火星巖石中存在大量的氮化鎵,氮化鎵為六方晶胞,結構如圖所示。若該晶體密度為dg·cm-3,晶胞參數a=b≠c(單位:nm),a、b夾角為120°,阿伏加德羅常數的值為NA,則晶胞參數c=___nm(寫出代數式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com