
據元素周期表及周期律的知識回答下列問題:
(1)請在下圖所示元素周期表中用實線畫出前36號元素所在的范圍的邊界。

(2)下列比較元素性質的遞變規律正確的是______________________________________ (填字母序號)。
a.離子半徑:Na+>Mg2+>S2->Cl-
b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氫化物穩定性:H2O>H2S>PH3>SiH4
d.NH3結合H+的能力比H2O弱
(3)元素甲是第3周期ⅦA族元素,甲元素與另兩種非金屬元素可組成離子化合物A,寫出A的電子式__________________。工業上可用MnSO4溶液吸收氯氣,獲得Mn2O3,請寫出該化學反應的化學方程式__________________________________。
(4)氮和氧都是較活潑的非金屬元素,用一個化學方程式說明兩種單質的氧化性強弱______________________。
(5)在所有元素的氣態氫化物中,元素乙的氫化物最穩定,寫出元素乙的單質與水反應的化學方程式______________________________________________________________
________________________________________________________________________。
(6)0.1 mol的單質Cl2與100 mL 1.5 mol·L-1的FeBr2溶液反應,則被氧化的Fe2+和Br-的物質的量之比是________________________________________________________。
答案 (1)

(2)bc
(3)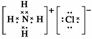 或
或
2MnSO4+Cl2+3H2O===Mn2O3+2H2SO4+2HCl
(4)4NH3+3O2 2N2+6H2O或4NH3+5O2
2N2+6H2O或4NH3+5O2 4NO+6H2O
4NO+6H2O
(5)2F2+2H2O===4HF+O2
(6)3∶1
解析 (2)a項,離子半徑S2->Cl->Na+>Mg2+;d項,NH3與酸反應易形成銨鹽,而H2O不和酸反應,所以NH3結合H+的能力比H2O強。(3)非金屬元素間能形成離子化合物的必須是銨鹽,元素甲為Cl,所以其離子化合物為NH4Cl,電子式為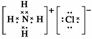 。在MnSO4和Cl2的反應中,Cl2作氧化劑,MnSO4作還原劑。(4)根據NH3的催化氧化判斷O2、N2的氧化性強弱。(5)F的非金屬性最強,氣態氫化物最穩定,F2和H2O反應生成HF和O2。(6)n(Cl2)=0.1 mol,n(Fe2+)=0.15 mol,n(Br-)=0.3 mol,被氧化的Fe2+為0.15 mol,被氧化的Br-為0.05 mol,其物質的量之比為3∶1。
。在MnSO4和Cl2的反應中,Cl2作氧化劑,MnSO4作還原劑。(4)根據NH3的催化氧化判斷O2、N2的氧化性強弱。(5)F的非金屬性最強,氣態氫化物最穩定,F2和H2O反應生成HF和O2。(6)n(Cl2)=0.1 mol,n(Fe2+)=0.15 mol,n(Br-)=0.3 mol,被氧化的Fe2+為0.15 mol,被氧化的Br-為0.05 mol,其物質的量之比為3∶1。


 課時訓練江蘇人民出版社系列答案
課時訓練江蘇人民出版社系列答案 黃岡經典趣味課堂系列答案
黃岡經典趣味課堂系列答案 啟東小題作業本系列答案
啟東小題作業本系列答案科目:高中化學 來源: 題型:
合成氨是人類科學技術上的一項重大突破,其反應原理為:
N2(g)+3H2(g) 2NH3(g) ∆H=—92.4kJ•mol‾1
2NH3(g) ∆H=—92.4kJ•mol‾1
一種工業合成氨的簡易流程圖如下:

(1)天然氣中的H2S雜質常用常用氨水吸收,產物為NH4HS。一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,寫出再生反應的化學方程式: 。
(2)步驟II中制氯氣原理如下:
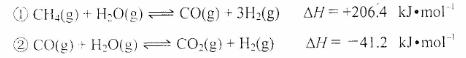
對于反應①,一定可以提高平衡體系中H2百分含量,又能加快反應速率的是 。
a.升高溫度 b.增大水蒸氣濃度 c.加入催化劑 d.降低壓強
利用反應②,將CO進一步轉化,可提高H2產量。若1mol CO和H2的混合氣體(CO的體積分數為20%)與H2O反應,得到1.18mol CO、CO2和H2的混合氣體,則CO轉化率為 。
(3)圖1表示500℃、60.0MPa條件下,原料氣投料比與平衡時NH3體積分數的關系。根據圖中a點數據計算N2的平衡體積分數: 。
(4)依據溫度對合成氨反應的影響,在圖2坐標系中,畫出一定條件下的密閉容器內,從通入原料氣開始,隨溫度不斷升高,NH3物質的量變化的曲線示意圖。
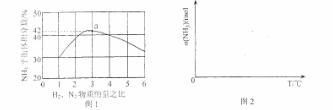
(5)上述流程圖中,使合成氨放出的熱量得到充分利用的主要步驟是(填序號) ,簡述本流程中提高合成氨原料總轉化率的方法: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
答案 (1)③④⑤⑥⑦⑧⑨ (2)B>A>C
解析 (1)元素原子得電子能力的強弱與元素氫化物的溶解性無關,所以①不符合題意;氫化物的酸性強弱和元素原子得電子能力大小沒有固定的對應關系,所以②也不符合題意,其他均符合題意。(2)由金屬B的最高價氧化物的水化物的堿性比A的最高價氧化物的水化物的堿性強,可判斷失電子能力B>A;又根據A與C形成原電池,C作正極,可判斷失電子能力A>C,故三種金屬元素的原子失電子能力B>A>C。
查看答案和解析>>
科目:高中化學 來源: 題型:
已知33As、35Br位于同一周期。下列關系正確的是 ( )
A.原子半徑:As>Cl>P
B.熱穩定性:HCl>AsH3>HBr
C.還原性:As3->S2->Cl-
D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化學 來源: 題型:
幾種短周期元素的原子半徑及主要化合價如下表:
| 元素代號 | X | Y | Z | M | R |
| 原子半徑/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合價 | +1 | +6 -2 | +5 -3 | -2 | +3 |
已知X是短周期中最活潑的金屬,且與R同周期。下列敘述不正確的是 ( )
A.離子半徑大小:Y2->M2->R3+
B.Z與M組成的化合物是形成酸雨的原因之一
C.將YM2通入BaCl2溶液中有大量白色沉淀產生
D.X、Y、R的最高價氧化物的水化物兩兩之間能發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
關于元素周期表,以下說法錯誤的是( )
A.計算機芯片的組成元素位于第14列
B.元素周期表共有7個周期,16個族
C.每一周期的元素都是從堿金屬開始,最后以稀有氣體結束
D.第二、三周期中,同一列上下相鄰元素的原子核外電子數相差8個
查看答案和解析>>
科目:高中化學 來源: 題型:
(I)X、Y、Z、A、L、E六種短周期主族元素的原子序數依次增大,其中X、E的單質在常溫下呈氣態,E在常溫下是黃綠色氣體;Y的原子的最外層電子數是其電子層數的2倍,Z在同周期的主族元素中原子半徑最大,A是地殼中含量最多的金屬元素,L的單質晶體熔點高、硬度大,是一種重要的半導體材料。
用化學用語回答下列問題:
(1)L的元素符號為 ;A在元素周期表中的位置為
(2)Y、L、E的最高價含氧酸的酸性由弱到強的順序是
(3)Y的最高價氧化物的電子式為 。
(II)下列物質A~F是我們熟悉的單質或化合物,其中A、E均為(I)中元素形成的單質,B是常見的金屬,且B的合金用量最大;在適當的條件下,它們之間可以發生如下圖所示的轉化。
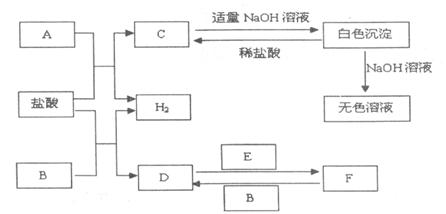
試回答下列問題:
(1)B的化學式是 ;
(2)反應F D的化學方程式 。
D的化學方程式 。
(3)檢驗F中金屬陽離子的常用方法是 。
(4)寫出C與過量氨水反應的離子方程式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
下列事實能證明甲烷分子是以碳原子為中心的正四面體結構的是
A.四個C-H鍵完全相同 B.CH4的一氯代物只有一種
C.在常溫常壓下CH2Cl2為液體 D.CH2Cl2只有一種空間結構
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com