
【題目】利用太陽能、風能、生物質能等可再生能源,轉化利用二氧化碳設計出適合高效清潔的合成燃料分子結構,實現CO2+H2O→CxHy的分子轉化,生產合成甲烷、醇醚燃料、烷烴柴油、航空燃油等可再生合成燃料。因此二氧化碳的捕集、利用是我國能源領域的一個重要戰略方向。
(1)一定條件下,在CO2與足量碳反應所得平衡體系中加入H2和適當催化劑,有下列反應發生:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1=-206.2kJ/mol
CH4(g)+H2O(g) △H1=-206.2kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2
CO2(g)+H2(g) H2
若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整個過程中放出的熱量為16.5kJ,則△H2=__。
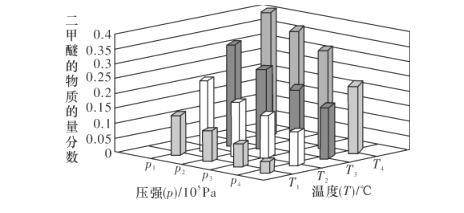
(2)合成二甲醚的總反應為2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某溫度下,將2.0molCO2(g)和6.0molH2(g)充入容積為2L的密閉容器中,反應到達平衡時,改變壓強和溫度,平衡體系中CH3OCH3(g)的物質的量分數變化情況如圖所示,則p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4時平衡常數分別為K3、K4則K3__K4,T1、p1時H2的平衡轉化率為___。(結果保留三位有效數字)
CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某溫度下,將2.0molCO2(g)和6.0molH2(g)充入容積為2L的密閉容器中,反應到達平衡時,改變壓強和溫度,平衡體系中CH3OCH3(g)的物質的量分數變化情況如圖所示,則p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4時平衡常數分別為K3、K4則K3__K4,T1、p1時H2的平衡轉化率為___。(結果保留三位有效數字)
(3)向2L密閉容器中加入2molCO2和6molH2,在適當的催化劑作用下,下列反應能自發進行:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①該反應△H__(填“>”“<”或“=”)0。
②下列敘述能說明此反應達到平衡狀態的是__(填字母代號)。
a.混合氣體的平均相對分子質量保持不變
b.1molCO2生成的同時有3molH-H鍵斷裂
c.CO2的轉化率和H2的轉化率相等
d.混合氣體的密度保持不變
③上述反應常用CuO和ZnO的混合物作催化劑。相同的溫度和時間段內,催化劑中CuO的質量分數對CO2的轉化率和CH3OH的產率影響的實驗數據如下表所示:
ω(CuO)% | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
CH3OH的產 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的轉化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的質量分數為__催化效果最佳。
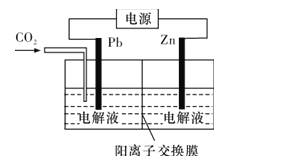
(4)CO2可用于工業制備草酸鋅,其原理如圖所示(電解液不參加反應),Zn電極是__極。已知在Pb電極區得到ZnC2O4,則Pb電極上的電極反應式為__。
【答案】-41.2kJ/mol > < 57.1% < ab 60 陽 2CO2+2e-==C2O42-
【解析】
(1)由“若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整個過程中放出的熱量為16.5kJ”,我們可寫出熱化學方程式為:CO2(g)+4H2(g)==CH4(g)+2H2O(g) △H=-165.0kJ/mol,利用蓋斯定律,可求出△H2。
(2)正反應為放熱的體積縮小的可逆反應,依據平衡移動原理,增大壓強、降低溫度,平衡都正向移動,提取圖中信息,便可得出p1與p2、K3與K4關系及T1、p1時H2的平衡轉化率。
(3)①利用H-TS<0,可判斷該反應的△H與0的關系。
②a.混合氣體的平均相對分子質量保持不變,則氣體的總物質的量不變;
b.1molCO2生成的同時有3molH-H鍵斷裂,反應的方向相反,數值之比等于化學計量數之比;
c.對于該反應,CO2的轉化率和H2的轉化率始終相等;
d.對于該反應,混合氣體的密度始終保持不變。
③由表中數據,可確定CuO的催化效果的最佳點。
(4)因為在Pb電極區得到ZnC2O4,則表明Pb電極上CO2得電子,作陰極,由此可確定Zn電極作電解池的電極名稱,并可寫出Pb電極上的電極反應式。
(1)由“若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整個過程中放出的熱量為16.5kJ”,我們可寫出熱化學方程式為:
CO2(g)+4H2(g)==CH4(g)+2H2O(g) △H=-165.0kJ/mol ①
CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1=-206.2kJ/mol ②
CH4(g)+H2O(g) △H1=-206.2kJ/mol ②
利用蓋斯定律,將②-①,即得CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=-41.2kJ/mol。答案為:-41.2kJ/mol;
CO2(g)+H2(g) H2=-41.2kJ/mol。答案為:-41.2kJ/mol;
(2)合成二甲醚的總反應為2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1,
CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1,
正反應為放熱的體積縮小的可逆反應,依據平衡移動原理,增大壓強,平衡正向移動;降低溫度,平衡正向移動,平衡常數增大。提取圖中信息,p1、T4時,二甲醚的物質的量分數大,所以p1>p2,T3>T4,則K3<K4。從圖中可以看出,T1、p1時,二甲醚的物質的量分數為0.1,假設某溫度下,將2.0molCO2(g)和6.0molH2(g)充入容積為2L的密閉容器中,反應到達平衡時,改變壓強和溫度,CO2的變化量為2x,三段式為:

則![]() ,x=
,x=![]() mol,H2的平衡轉化率為
mol,H2的平衡轉化率為![]() =57.1%。答案為:>;<;57.1%;
=57.1%。答案為:>;<;57.1%;
(3) ①S<0,利用H-TS<0,可判斷該反應的△H<0。答案為:<;
②a.混合氣體的平均相對分子質量保持不變,則氣體的總物質的量不變,表明反應達平衡狀態,a符合題意;
b.1molCO2生成的同時有3molH-H鍵斷裂,反應的方向相反,數值之比等于化學計量數之比,表明反應達平衡狀態,b符合題意;
c.對于該反應,反應物的起始投入量之比等于化學計量數之比,所以不管反應進行到什么程度,CO2的轉化率和H2的轉化率始終相等,則反應不一定達平衡狀態,c不合題意;
d.對于該反應,混合氣體的質量與體積都不變,所以密度始終保持不變,反應不一定達平衡狀態,d不合題意。答案為:ab;
③由表可知,CuO的質量分數為60%時,CH3OH的產率、CO2的轉化率都達最大值,催化效果最佳。答案為:60; (4)因為在Pb電極區得到ZnC2O4,則表明Pb電極上CO2得電子,Zn電極失電子作陽極;在陰極,CO2得電子生成C2O42-,與從陽極區通過陽離子交換膜遷移的Zn2+在陰極區發生反應生成ZnC2O4,電極反應式為2CO2+2e-==C2O42-。答案為:陽;2CO2+2e-==C2O42-。


科目:高中化學 來源: 題型:
【題目】經過德國化學家哈伯、波施等的不懈努力,成功地開發了合成氨的生產工藝。如今 世界各國科學家為提高氨的產量,降低能耗做著各種有益的探索。試回答下列問題:
(1)已知NH3(l)NH3(g) △H1;N2(g)+3H2(g)2NH3(l) △H2 。則反應N2(g)+3H2(g)2NH3(g) 的△H=_______(用含 △H1、△H2的代數式表示)
(2)①在一定條件下,分別將 1mol N2和3mol H2置于恒壓容器Ⅰ和恒容容器Ⅱ中 兩容器起始容積相同充分反應,二者均達到平衡狀態,則兩容器中NH3 的體積分數是Ⅰ_______Ⅱ(填“>”、“<”或“=” 。)
②上述容積恒定的密閉容器中,達化學平衡狀態時, 若NH3 的體積分數為10% ,若保持其他條 件不變,起始時改為充入2 mol N2和2molH2,達新平衡后,NH3的體積分數為_______10%填(“>”、“<”或“=”)。
(3)哈伯因證實 N2、H2 在固體催化劑(Fe)表面吸附和解吸以合成氨的過程而獲諾貝爾獎。若用![]() 分別表示 N2、H2、NH3 和固體催化劑,則在固體催化劑表面合成氨的過程可用如圖表示:
分別表示 N2、H2、NH3 和固體催化劑,則在固體催化劑表面合成氨的過程可用如圖表示:
![]()
①吸附后,能量狀態最低的是___________填字母序號)。
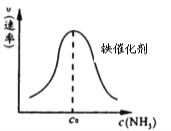
②由上述原理,在鐵表面進行 NH3 的分解實驗,發現分解速率與濃度關系如圖。從吸附和解吸過程分析,c0前速率增加的原因可能是_________________________;c0 后速率降低的原因可能是___________________。
(4)已知液氨中存在:2NH3(l)NH2-+NH4+。用 Pt 電極對液氨進行電解也可產生 H2和 N2。陰極的電極反應式是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬材料、無機非金屬材料、有機高分子材料是人類使用的三大類基礎材料,它們以各自的特點滿足著人類多方面的需要。
(1)金屬材料中,有一類貯氫合金能夠結合氫氣形成金屬化合物,并在一定條件下分解釋放出氫氣,該貯運原理屬于_______變化,鋼鐵是制造輪船的主要金屬材料,船身外通常裝上一定數目比鐵更活潑的金屬塊以防止腐蝕,該金屬塊可以選擇_______(選填“銅塊”、“鋅塊”、“鉛塊”);
(2)無機非金屬材料中,用于電子工業的高純碳酸鈣、高純氧化鈣生產流程如下:

請回答下列問題:
①硝酸鈣與碳酸銨在溶液中反應,其基本反應類型為_______;
②實驗室常采用_______操作進行沉淀分離;
③生產高純碳酸鈣時,選擇“220℃恒溫干燥”而不選擇“灼燒”的原因是_______;
④高純氧化鈣生產過程中,“干燥”的主要目的是為了防止______(用化學方程式表示);
(3)有機高分子材料“玉米塑料”,因其可降解被廣泛用來替代一次性泡沫塑料,“玉米塑料”的使用可減少_______污染,20世紀30年代,尼龍因其抽成細絲極像蠶絲而被推向世界,生活中可采用______方法區分尼龍和蠶絲。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗不能達到目的的是( )
選項 | 目的 | 實驗 |
A | 制取較高濃度的次氯酸溶液 | 將Cl2通入小蘇打溶液中 |
B | 除去溴苯中的少量溴 | 加入苛性鈉溶液洗滌、分液 |
C | 加快氫氣的生成速率 | 將與稀硫酸反應的粗鋅改為純鋅 |
D | 制備少量氨氣 | 向新制生石灰中滴加濃氨水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某種燃料含有碳、氫、氧三種元素。為了測定這種燃料中碳和氫兩種元素的質量比,可將氣態燃料放入足量的O2中燃燒,并使產生的氣體全部通過如圖所示裝置中,得到如表中所列的實驗結果(假設產生的氣體完全被吸收)。
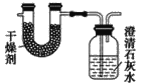
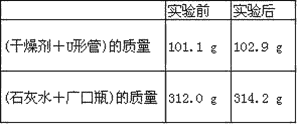
根據實驗數據求:
(1)實驗完畢后,生成物中水的質量為________g。假設廣口瓶里生成一種正鹽,其質量為_____________g。
(2)生成的水中氫元素的質量為_______g。
(3)生成的二氧化碳中碳元素的質量為_______ g。
(4)該燃料中碳元素與氫元素的質量比為_______。
(5)已知這種燃料的每個分子中含有一個氧原子,則該燃料的分子式為_______,結構簡式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列混合物中可用分液漏斗分離,且有機物應從分液漏斗上口倒出的是 ( )
A.![]() 、Br2
、Br2
B.CH3Cl、H2O
C.CCl4、CHCl3
D.CH2Br—CH2Br、NaBr(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】烯烴A在一定條件下可以按框圖進行反應:

已知:①D是
②F1和F2互為同分異構體
③G1和G2互為同分異構體
根據框圖信息,填寫下列空白:
(1)A的結構簡式是____。
(2)框圖中屬于取代反應的是(填數字代號):____。
(3)框圖中①、③、⑥屬于____反應。
(4)G1的結構簡式是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設 NA為阿伏加德羅常數的值,下列說法不正確的是
A.2 mol SO2 和 1 mol O2 混合在 V2O5 存在的條件下于密閉容器中加熱反應后,容器內物質分子數大于2NA
B.某溫度下純水的 pH=6,該溫度下 1L pH=11 的NaOH 溶液中含OH-的數目為 0.1NA
C.一定溫度下,1 L 0.5 mol·L -1 NH4Cl 溶液與 2 L 0.25 mol·L -1NH4Cl 溶液含NH+均為 0.5NA
D.100 g CaCO3 與 KHCO3 的混合物中含有的陰離子的數目為 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:下表為25℃時某些弱酸的電離平衡常數。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
如圖表示常溫下,稀釋CH3COOH、HClO兩種酸的稀溶液時,溶液pH隨加水量的變化.下列說法正確的是( )

A.Ⅰ曲線代表HClO,Ⅱ曲線代表CH3COOH
B.向NaClO溶液中通入少量二氧化碳的離子方程式為:ClO﹣+CO2+H2O=HClO+CO32-
C.圖象中a、c兩點處的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.圖象中a點酸的總濃度大于b點酸的總濃度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com