
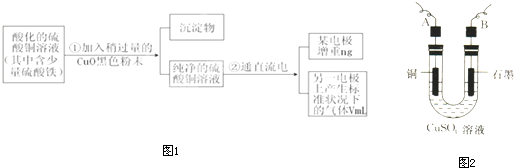
| ||
| ||
| 11200 |
| V |
| 11200 |
| V |
| ||
| ||
| V×10-3L |
| 22.4L/mol |
| V |
| 22400 |
| m |
| Mr |
| V |
| 22400 |
| 11200 |
| V |
| 11200 |
| V |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 12.4 |

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
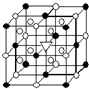 A.(1)右圖所示為冰晶石(化學式為Na3AlF6)的晶胞.圖中●位于大立方體頂點和面心,○位于大立方體的12條棱的中點和8個小立方體的體心,▽圖中●、○中的一種.圖中●、○分別指代哪種粒子
A.(1)右圖所示為冰晶石(化學式為Na3AlF6)的晶胞.圖中●位于大立方體頂點和面心,○位于大立方體的12條棱的中點和8個小立方體的體心,▽圖中●、○中的一種.圖中●、○分別指代哪種粒子| 熔點/K | 沸點/K | 標準狀況時在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
查看答案和解析>>
科目:高中化學 來源: 題型:

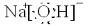
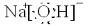
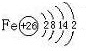
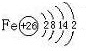
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
(20分)聚合氯化鋁是一種新型、高效絮凝劑和凈水劑,其單體是液態的堿式氯化鋁[Al2(OH)nCl6-n]。本實驗采用鋁鹽溶液水解絮凝法制備堿式氯化鋁。其制備原料為分布廣、價格廉的高嶺 土,化學組成為:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量雜質和水分。已知氧化鋁有多種不同的結構,化學性質也有差異,且一定條件下可相互轉化;高嶺土中的氧化鋁難溶于酸。制備堿式氯化鋁的實驗流程如下:
已知:Fe3+、Al3+以氫氧化物形式完全沉淀時,溶液的pH分別為3.2、5.2。
根據流程圖回答下列問題:
(1)“煅燒”的目的是_______________________________________________。
(2)“浸出”過程中發生反應的離子方程式為_______________________________。
(3)“浸出”選用的酸為_______。配制質量分數15%的A酸需要200mL30%的A酸(密度約為1.15g/cm3)和_______g蒸餾水,配制用到的儀器有燒杯、玻璃棒、______________。
(4)為提高鋁的浸出率,可采取的措施有 _______________(要求寫出三條)。
(5)“調節溶液pH在4.2~4.5”的過程中,除添加必要的試劑,還需借助的實驗用品是_________________;“蒸發濃縮”需保持溫度在90~100℃,控制溫度的實驗方法是___________ ______。
(6)實驗中制備堿式氯化鋁反應的化學方程式為_________________
查看答案和解析>>
科目:高中化學 來源:2012屆江蘇省揚州中學高三3月雙周練習(二)化學試卷(帶解析) 題型:填空題
(20分)聚合氯化鋁是一種新型、高效絮凝劑和凈水劑,其單體是液態的堿式氯化鋁[Al2(OH)nCl6-n]。本實驗采用鋁鹽溶液水解絮凝法制備堿式氯化鋁。其制備原料為分布廣、價格廉的高嶺土,化學組成為:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量雜質和水分。已知氧化鋁有多種不同的結構,化學性質也有差異,且一定條件下可相互轉化;高嶺土中的氧化鋁難溶于酸。制備堿式氯化鋁的實驗流程如下: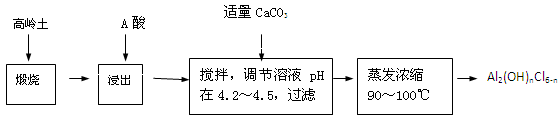
已知:Fe3+、Al3+以氫氧化物形式完全沉淀時,溶液的pH分別為3.2、5.2。
根據流程圖回答下列問題:
(1)“煅燒”的目的是_______________________________________________。
(2)“浸出”過程中發生反應的離子方程式為_______________________________。
(3)“浸出”選用的酸為_______。配制質量分數15%的A酸需要200mL30%的A酸(密度約為1.15g/cm3)和_______g蒸餾水,配制用到的儀器有燒杯、玻璃棒、______________。
(4)為提高鋁的浸出率,可采取的措施有 _______________(要求寫出三條)。
(5)“調節溶液pH在4.2~4.5”的過程中,除添加必要的試劑,還需借助的實驗用品是_________________;“蒸發濃縮”需保持溫度在90~100℃,控制溫度的實驗方法是___________ ______。
(6)實驗中制備堿式氯化鋁反應的化學方程式為_________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com