
【題目】含氮化合物與生產、生活、生命和環境息息相關。
(1)NO加速臭氧層被破壞,其反應過程如圖所示。
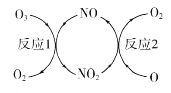
①NO的作用是________________________。
②已知:O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
反應l:O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
則反應2的熱化學方程式為____________________________。
(2)肌紅蛋白(Mb)是肌肉內儲存氧的蛋白質,構成肌紅蛋白的甘氨酸(H2NCH2COOH)是一種兩性物質,在溶液中以三種離子形式存在,其轉化關系如下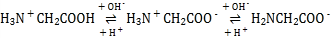 三種離子的物質的量分數(δ)與[
三種離子的物質的量分數(δ)與[![]() ]的關系如圖所示。
]的關系如圖所示。
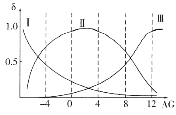
①溶液呈中性時,三種離子濃度由大到小的順序為______________________。
②向AG=12的溶液中加入過量NaOH溶液時,主要反應的離子方程式為______________。
(3)肌紅蛋白(Mb)可與O2結合生成MbO2:![]() 。37℃時測得肌紅蛋白的結合度(α)與p(O2)的關系如下表。
。37℃時測得肌紅蛋白的結合度(α)與p(O2)的關系如下表。
[結合度(α)指已與O2結合的肌紅蛋白占總肌紅蛋白的物質的量分數]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
①計算37℃時,上述反應的平衡常數K=__________kPa-1(氣體和溶液中的溶質分別用分壓和物質的量濃度表示)。
②37℃時,若空氣中氧氣分壓為21.0 kPa,則人正常呼吸時α的最大值為________%(保留1位小數)。
③溫度不變時,游客在山頂時體內MbO2的濃度比在山下________(填“高”或“低”)。
④研究發現,v正=k正·c(Mb)·p(O2),v逆=k
【答案】催化劑 NO2(g)+O(g)=NO(g)+O2(g) △H=+57.2KJ/mol c(H3N+CH2COO-)>c(H2NCH2COO-)>c(H3N+CH2COOH) H3N+CH2COOH+2OH-= H2NCH2COO-+2H2O 2 97.7 低 120s-1 KPa-1
【解析】
(1)①NO只是參與化學反應中間歷程的,而其本身的數量和化學性質在反應前后基本保持不變;
②利用蓋斯定律解題;
(2)隨著橫坐標增大,堿性減弱,酸性增強,根據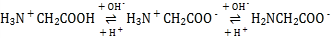 可知H2NCH2COO-堿性越強含量越大,H3N+CH2COO-在接近中性時含量最大,H3N+CH2COOH酸性越強含量越大,由此確定Ⅰ線為H2NCH2COO-,Ⅱ線為H3N+CH2COO-,Ⅲ線為H3N+CH2COOH,以此分析;
可知H2NCH2COO-堿性越強含量越大,H3N+CH2COO-在接近中性時含量最大,H3N+CH2COOH酸性越強含量越大,由此確定Ⅰ線為H2NCH2COO-,Ⅱ線為H3N+CH2COO-,Ⅲ線為H3N+CH2COOH,以此分析;
(3)①K=![]() kPa-1,利用表格中數據進行計算;
kPa-1,利用表格中數據進行計算;
②利用①中計算的K計算即可;
③根據表格提供數據可知p(O2)越小,結合度越低,c(MbO2)越小;
④利用①中計算的K,根據平衡時v正= v逆進行計算;
(1)①NO只是參與化學反應中間歷程的,而其本身的數量和化學性質在反應前后基本保持不變,因此NO的作用是催化劑;
答案:催化劑
②利用蓋斯定律,根據已知;O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
前者減去后者可得:NO2(g)+O(g)=NO(g)+O2(g) △H=+57.2kJ/mol
答案:NO2(g)+O(g)=NO(g)+O2(g) △H=+57.2kJ/mol
(2)①隨著橫坐標增大,堿性減弱,酸性增強,根據題干可知堿性越強H2NCH2COO-含量越大,在AG=0~4范圍時H3N+CH2COO-含量最大,酸性越強H3N+CH2COOH含量越大,由此確定Ⅰ線為H2NCH2COO-,Ⅱ線為H3N+CH2COO-,Ⅲ線為H3N+CH2COOH,溶液呈中性也就是AG=0,三種離子濃度由大到小的順序可根據圖像得到為c(H3N+CH2COO-)>c(H2NCH2COO-)>c(H3N+CH2COOH);
答案:c(H3N+CH2COO-)>c(H2NCH2COO-)>c(H3N+CH2COOH)
②根據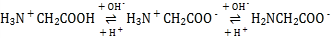 可知加入過量NaOH溶液時溶液中主要存在H2NCH2COO-,AG=12時溶液中主要存在H3N+CH2COOH,據此寫出離子方程式為: H3N+CH2COOH+2OH-= H2NCH2COO-+2H2O;
可知加入過量NaOH溶液時溶液中主要存在H2NCH2COO-,AG=12時溶液中主要存在H3N+CH2COOH,據此寫出離子方程式為: H3N+CH2COOH+2OH-= H2NCH2COO-+2H2O;
答案:H3N+CH2COOH+2OH-= H2NCH2COO-+2H2O
(3)①K=![]() kPa-1,利用表格中第一組數據可知:設肌紅蛋白總濃度c
kPa-1,利用表格中第一組數據可知:設肌紅蛋白總濃度c
![]()
c×(1-50%) 0.50kPa c×50%
K=![]() =2
=2
②利用①中計算所得K=2計算即可;
2=![]() ,得α=97.7;
,得α=97.7;
答案:97.7
③根據表格提供數據可知p(O2)越小,結合度越低, MbO2濃度越低;
答案:低
④利用①中計算的K=2,根據平衡時v正= v逆進行計算;
平衡時v正= v逆, 則k正·c(Mb)·p(O2)=k逆·c(MbO2),得K正=![]() = k逆×K=60s-1×2kPa-1=120s-1 KPa-1;
= k逆×K=60s-1×2kPa-1=120s-1 KPa-1;
答案: 120s-1 KPa-1


科目:高中化學 來源: 題型:
【題目】實驗室制備苯甲醇和苯甲酸的化學原理是: ,
,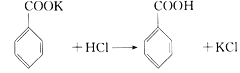 。已知苯甲醛易被空氣氧化,苯甲醇的沸點為205.3℃;苯甲酸的熔點為121.7℃,沸點為249℃,常溫下,在水中的溶解度為0.34g;乙醚的沸點為34.8℃,難溶于水。制備苯甲醇和苯甲酸的主要過程如下所示:
。已知苯甲醛易被空氣氧化,苯甲醇的沸點為205.3℃;苯甲酸的熔點為121.7℃,沸點為249℃,常溫下,在水中的溶解度為0.34g;乙醚的沸點為34.8℃,難溶于水。制備苯甲醇和苯甲酸的主要過程如下所示:

試根據上述信息回答下列問題:
(1)操作I的名稱是________,乙醚溶液中所溶解的主要成分是____________;
(2)操作Ⅱ的名稱是________,產品甲是________。
(3)操作Ⅲ的名稱是________,產品乙是________。
(4)如圖所示,操作Ⅱ中溫度計水銀球上沿放置的位置應是____(填“a”、“b”、“c” 或“d”),收集乙醚產品的適宜溫度為___。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,可逆反應2NO2(g) ![]() 2NO(g)+O2(g)在體積固定的密閉容器中反應,達到平衡狀態的標志是
2NO(g)+O2(g)在體積固定的密閉容器中反應,達到平衡狀態的標志是
①單位時間內生成nmol O2,同時生成2nmol NO2 ②混合氣體的密度不再變化
③用NO2、NO、O2的物質的量濃度變化表示的反應速率的比為2∶2∶1
④混合氣體的壓強不再改變 ⑤混合氣體的顏色不再改變
⑥混合氣體的平均相對分子質量不再改變
A. 以上全部 B. ①②③⑤ C. ②③⑤⑥ D. ①④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某可逆反應:mA(g)+nB(g)![]() xC(g) ΔΗ=QkJ/mol ,在密閉容器中進行,表示反應在不同時間t ,溫度T和壓強P與C在混合氣體中的百分含量(C%)的關系曲線,則
xC(g) ΔΗ=QkJ/mol ,在密閉容器中進行,表示反應在不同時間t ,溫度T和壓強P與C在混合氣體中的百分含量(C%)的關系曲線,則

A. T1>T2 ,P1>P2 ,m+n>x ,Q>0
B. T1<T2 ,P1<P2 ,m+n<x ,Q>0
C. T1>T2 ,P1<P2 ,m+n<x ,Q<0
D. T1<T2 ,P1<P2 ,m+n>x ,Q<0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積可變的密閉容器中通入一定量的X,發生反應:mX(g)![]() nY(g)+Z(g)△H=QkJ·mol-1。反應達到平衡時,Y的物質的量濃度與溫度、氣體體積的關系如表所示:
nY(g)+Z(g)△H=QkJ·mol-1。反應達到平衡時,Y的物質的量濃度與溫度、氣體體積的關系如表所示:
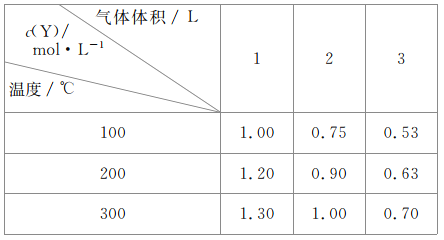
下列說法正確的是
A.m>n+1
B.溫度不變,壓強增大,Y的體積分數減少
C.Q<0
D.體積不變,溫度升高,平衡向逆反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應A(g)![]() B(g)
B(g)
(1)該反應的速率方程可表示為V正=K正CA,V逆=K逆CB,K正和K逆在一定溫度時為常數,分別稱作正,逆反應速率常數。已知T1溫度下,K正=0.004s-1 ,K逆=0.002s-1,該溫度下反應的平衡常數值K=______。該反應的活化能Ea(正)大于Ea(逆),則![]() ____0(填“>”“<”或“=”)。
____0(填“>”“<”或“=”)。
(2)對于該反應A(g)![]() B(g),在313 K和353 K時A的轉化率隨時間變化的結果如圖所示。
B(g),在313 K和353 K時A的轉化率隨時間變化的結果如圖所示。

①在313 K時反應的平衡轉化率α=_______%。平衡常數K313 K___K353 K(填“>”“<”或“=”),理由是________________________________。
②在353 K下:要提高A的轉化率,可采取的措施是___________;要縮短反應達到平衡的時間,可采取的措施有____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出現白色沉淀,繼續滴加一滴KI溶液并振蕩,沉淀變為黃色,再滴入一滴Na2S溶液并振蕩,沉淀又變成黑色,根據上述變化過程,分析此三種沉淀物的溶解度關系為
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:25 ℃時,CH3COOH和NH3·H2O的電離常數相等。
(1)25 ℃時,取10 mL 0.1 mol·L-1醋酸溶液測得其pH=3。
①將上述(1)溶液加水稀釋至1 000 mL,溶液pH數值范圍為___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“減小”“不變”或“不能確定”)。
②25 ℃時,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH試紙測定該氨水pH的操作方法為_______________________________________________________。
③氨水(NH3·H2O溶液)電離平衡常數表達式Kb=_______________________________,25 ℃時,氨水電離平衡常數約為___________。
(2)25 ℃時,現向10 mL 0.1 mol·L-1氨水中滴加相同濃度的CH3COOH溶液,在滴加過程中c(NH4+)/c(NH3.H2O)___________(填序號)。
a.始終減小 b.始終增大 c.先減小再增大 d.先增大后減小
(3)某溫度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等濃度的醋酸溶液,溶液中pOH與pH的變化關系如圖。已知:pOH=- lgc(OH-)。
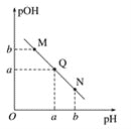
圖中M、Q、N三點所示溶液呈中性的點是___________(填字母,下同)。
圖中M、Q、N三點所示溶液中水的電離程度最大的點可能是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2.7g鋁溶解于100mL 3 mol·L-1 NaOH溶液中,然后向所得溶液中加入400mL 1 mol·L-1鹽酸,最后可得沉淀的質量是()
A.2.7gB.5.2gC.7.8gD.10g
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com