
【題目】甲、乙、丙、丁四種物質中,甲、乙、丙均含有相同的某種元素,它們之間的轉化關系如圖所示。下列有關物質的推斷正確的是( )
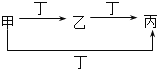
甲 | 乙 | 丙 | 丁 | |
A | S | SO2 | SO3 | O2 |
B | CO32- | HCO3- | CO2 | H+ |
C | Cl2 | FeCl3 | FeCl2 | Fe |
D | Al3+ | Al(OH)3 | AlO2- | NH3H2O |
A.AB.BC.CD.D
科目:高中化學 來源: 題型:
【題目】某密閉容器中充入等物質的量的氣體A和B,一定溫度下發生反應A(g)+xB(g) ![]() 2C(g),達到平衡后,只改變反應的一個條件,測得容器中物質的濃度、反應速率隨時間的變化如下圖所示。下列說法中正確是
2C(g),達到平衡后,只改變反應的一個條件,測得容器中物質的濃度、反應速率隨時間的變化如下圖所示。下列說法中正確是
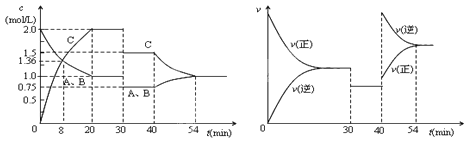
A.前8min A的平均反應速率為0.08mol/(L·s)
B.30min時擴大容器的體積,40min時升高溫度
C.反應方程式中的x=1,正反應為吸熱反應
D.30min和54min的反應的平衡常數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤燃燒排放的煙氣含有SO2和NOx,形成酸雨、污染大氣,采用NaClO2溶液作為吸收劑可同時對煙氣進行脫硫、脫硝,回答下列問題:
(1)在鼓泡反應器中通入含有SO2和NOx的煙氣,反應溫度為323K,NaClO2堿性溶液濃度為5×103mol·L1。反應一段時間后溶液中離子濃度的分析結果如表。
離子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/mol·L1 | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①寫出NaClO2堿性溶液脫硝(NO)過程中主要反應的離子方程式:____。增加壓強,NO的轉化率___(填“提高”“不變”或“降低”)
②由實驗結果可知,脫硫反應速率大于脫硝反應速率,原因是除了SO2和NO在煙氣中的初始濃度不同,還可能是___。
(2)在不同溫度下,NaClO2溶液脫硫、脫硝的反應中,SO2和NO的平衡分壓px如圖所示。
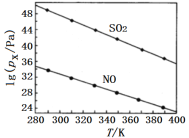
由圖分析可知,反應溫度升高,脫硫、脫硝反應的平衡常數均___(填“增大”“不變”或“減小”)。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到較好的煙氣脫硫效果。從化學平衡原理分析,Ca(ClO)2相比NaClO具有的優點是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)蘇丹紅顏色鮮艷、價格低廉,常被一些企業非法作為食品和化妝品等的染色劑,嚴重危害人們健康。蘇丹紅常見有Ⅰ、Ⅱ、Ⅲ、Ⅳ4種類型,蘇丹紅Ⅰ的分子結構如圖1所示。
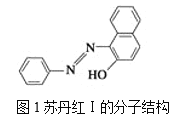
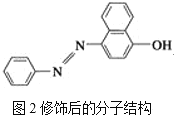
蘇丹紅Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羥基取代在對位形成圖2所示的結構,則其在水中的溶解度會____(填“增大”或“減小”),原因是__________________。
(2)Co(NH3)5BrSO4可形成兩種鈷的配合物,已知Co3+的配位數是6,為確定鈷的配合物的結構,現對兩種配合物進行如下實驗:在第一種配合物的溶液中加BaCl2溶液時,產生白色沉淀;在第二種配合物溶液中加入BaCl2溶液時,則無明顯現象,則第一種配合物的結構式為__________,第二種配合物的結構式為_____。
(3)Ag+能與NH3、S2O32-、CN等形成配位數為2的配合物。
利用AgNO3和氨水可配制[Ag(NH3)2]OH溶液,在[Ag(NH3)2]OH中存在的化學鍵的類型有_____(填字母)。
A 離子鍵 B 金屬鍵 C 配位鍵 D 非極性鍵 E 極性鍵
(4)NO3-中N原子的雜化軌道類型是____,空間構型為_____。寫出一種與NO2-,SO2互為等電子體的短周期元素單質分子的化學式_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼化釩(VB2)—空氣電池是目前儲電能力最高的電池,電池示意圖:
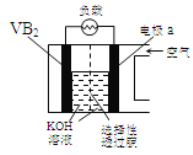
該電池工作時反應為:4VB2+ 11O2 = 4B2O3+ 2V2O5。下列說法正確的是
A.VB2極發生的電極反應為:2VB2+ 22OH-22e=V2O5+ 2B2O3+ 11H2O
B.電極a為電池負極
C.電流由VB2極經負載流向電極a
D.圖中選擇性透過膜允許陽離子選擇性透過
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃燒法是確定有機物分子式常用的方法:在電爐加熱時用純O2氧化管內樣品,根據產物的質量確定有機物的組成。若實驗中所取樣品A只含C、H、O三種元素中的兩種或三種,準確稱取0.92 g樣品,經充分反應后,測得生成1.76 gCO2和1.08 g水;回答下列問題:
(1)樣品A的實驗式為____________。能否根據A的實驗式確定A的分子式_______ (填“能”或“不能”),若能,則A的分子式是____________________ (若不能,則此空不填)。
(2)樣品A不能與金屬鈉反應,則其結構簡式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知氣態烴A在標準狀況下的密度是1.16 g·L1,B的產量可以用來衡量一個國家石油化工發展水平,G是一種高分子化合物。現有 A、B、C、D、E、F、G 存在如下關系:
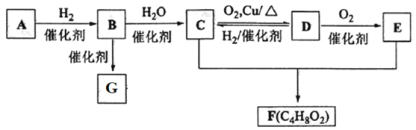
請回答:
(1)D中的官能團名稱是_______________。 B的結構式為_________;
(2)寫出 C+E→F反應的化學方程式__________;
(3)寫出 C→D反應的化學方程式為__________;
(4)已知三分子 A 在一定條件下可合成不能使酸性 KMnO4 溶液褪色的有機物,寫出該合成反應的化學方程式___________,反應類型為___________。
(5)下列有關敘述正確的是_____________。
a. A、B、C、D、E、F、G均為非電解質
b. A中所有原子不可能處于同一平面上
c. 加熱時,D 能與新制氫氧化銅懸濁液反應生成磚紅色沉淀
d.75%(體積分數)的 C 水溶液常用于醫療消毒
e. 將綠豆大小的鈉塊投入 C 中,鈉塊浮于液面上,并有大量氣泡產生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E均為有機物,其中A是化學實驗中常見的有機物,它易溶于水并有特殊香味;B的產量可衡量一個國家石油化工發展的水平,有關物質的轉化關系如圖甲所示:
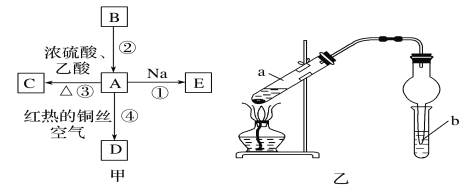
(1)C的結構簡式__;A中官能團的名稱為__。
(2)寫出下列反應的化學方程式:
反應①__;
反應④__。
(3)實驗室利用反應③制取C,常用圖乙裝置:
①a試管中主要反應的化學方程式為__。反應類型是__。
②在實驗中用到了:鐵架臺(鐵夾),酒精燈,試管,導管(橡膠管)和__。(填儀器名稱)
③試管b中溶液名稱為__,實驗后觀察到的現象是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】霧霾天氣嚴重影響人們的生活和健康。因此采取改善能源結構、機動車限號等措施來減少PM2.5、SO2、NOx等污染。請回答下列問題:
Ⅰ. 臭氧是理想的煙氣脫硝劑,其脫硝的反應之一為:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同溫度下,在兩個恒容容器中發生該反應,相關信息如下表及圖所示,回答下列問題:
N2O5(g)+O2(g),不同溫度下,在兩個恒容容器中發生該反應,相關信息如下表及圖所示,回答下列問題:
容器 | 甲 | 乙 |
容積/L | 1 | 1 |
溫度/K | T1 | T2 |
起始充入量 | 1molO3和2molNO2 | 1molO3和2molNO2 |
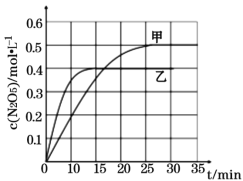
①0~15min內乙容器中反應的平均速率:v(NO2) =____(計算結果保留兩位小數)。
②該反應的正反應為____(填“吸熱”或“放熱”)反應。
③T1時平衡后,向恒容容器中再充入1molO3和2molNO2,再次平衡后,NO2的百分含量將____(填“增大”“減小”或“不變”)。
④反應體系在溫度為T1時的平衡常數為____。
⑤在恒溫恒容條件下,下列條件不能證明該反應已經達到平衡的是____。
a.容器內混合氣體壓強不再改變
b.消耗2n molNO2的同時,消耗了n molO3
c.混合氣體的平均相對分子質量不再改變
d.混合氣體密度不再改變
II. 某化學小組查閱資料后得知:2NO(g)+O2(g) ![]() 2NO2(g) 的反應歷程分兩步:
2NO2(g) 的反應歷程分兩步:
①2NO(g)=N2O2(g) (快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
②N2O2(g)+O2(g)=2NO2(g) (慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2)
請回答下列問題:
(1)已知決定2NO(g)+O2(g) ![]() 2NO2(g)反應速率的是反應②,則反應①的活化能E1與反應②的活化能E2的大小關系為E1____E2(填“>”“<”或“=”)。
2NO2(g)反應速率的是反應②,則反應①的活化能E1與反應②的活化能E2的大小關系為E1____E2(填“>”“<”或“=”)。
(2)一定溫度下,反應2NO(g)+O2(g) ![]() 2NO2(g)達到平衡狀態,寫出用k1正、k1逆、k2正、k2逆表示平衡常數的表達式K=____。
2NO2(g)達到平衡狀態,寫出用k1正、k1逆、k2正、k2逆表示平衡常數的表達式K=____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com