計算題:在由銅片、鋅片和200mL稀硫酸組成的原電池中,當在銅片上放出3.36L(標準狀況)的H2時,硫酸恰好用完,則:
(1)產生這些氣體消耗的鋅的質量是______ 克;
(2)通過導線的電子的物質的量是______ mol
(3)原稀硫酸的物質的量濃度是______ mol/L.
【答案】
分析:(1)根據氫氣和鋅的關系式計算;
(2)根據氫氣和轉移電子的關系式計算;
(3)根據氫氣和硫酸的關系式計算硫酸的物質的量,再根據物質的量濃度公式計算硫酸的物質的量濃度;
解答:解:(1)Zn+H
2SO
4 =ZnSO
4 +H
2↑
65g 22.4L
9.75g 3.36L
故答案為9.75;
(2)Zn+H
2SO
4 =ZnSO
4 +H
2↑ 轉移電子
22.4L 2 mol
3.36L 0.3mol
故答案為0.3;
(3)Zn+H
2SO
4 =ZnSO
4 +H
2↑
1mol 22.4L
0.15mol 3.36L
溶液中硫酸的物質的量為0.15mol;
所以稀硫酸的物質的量濃度C=
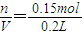
=0.75mol/L
故答案為0.75;
點評:本題以原電池為載體考查了反應方程式的有關計算,正確找出各物質間的關系是解本題的關鍵.

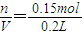 =0.75mol/L
=0.75mol/L
