
【題目】堿式次氯酸鎂[Mg2ClO(OH)3H2O]微溶于水,不潮解,相對穩定,是一種有開發價值的無機抗菌劑,以菱鎂礦(MgCO3,含少量FeCO3)為主要原料制備堿式次氯酸鎂的工業流程如下:
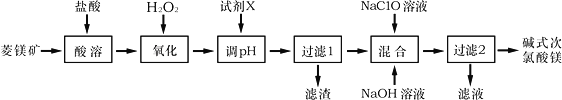
回答下列問題:
(1)菱鎂礦“酸溶”時,為了提高溶出率,可采取的措施有________________(寫一條)。
(2)H2O2的電子式為___________,它的作用是___________________________________。
(3)“調pH”時加入的試劑X為______________(填化學式)。
(4)“混合”時發生反應的化學方程式為__________________________________________。
“混合”時NaOH溶液需最后加入且不能過量,其原因是__________________________。
(5)在酸性溶液中堿式次氯酸鎂具有殺菌、漂白作用的原因是_____________(用離子方程式表示)。
(6)如果以單位質量的消毒劑所得到的電子數來表示消毒效率,堿式次氯酸鎂的消毒效率是Cl2的消毒效率的_______倍(計算結果保留兩位小數)。
【答案】 粉碎菱鎂礦或增大鹽酸濃度等 ![]() 將Fe2+氧化為Fe3+ MgO [Mg(OH)2 、MgCO3或Mg(OH)2CO3] NaClO+2MgCl2+3NaOH+H2O=Mg2ClO(OH)3H2O↓+4NaCl 防止生成Mg(OH)2沉淀 Mg2ClO(OH)3H2O+4H+ =2Mg2++HClO+4H2O (或Mg2ClO(OH)3+4H+ =2Mg2++HClO+3H2O) (2分) 0.42
將Fe2+氧化為Fe3+ MgO [Mg(OH)2 、MgCO3或Mg(OH)2CO3] NaClO+2MgCl2+3NaOH+H2O=Mg2ClO(OH)3H2O↓+4NaCl 防止生成Mg(OH)2沉淀 Mg2ClO(OH)3H2O+4H+ =2Mg2++HClO+4H2O (或Mg2ClO(OH)3+4H+ =2Mg2++HClO+3H2O) (2分) 0.42
【解析】(1)菱鎂礦“酸溶”時,可通過粉碎菱鎂礦、增大鹽酸濃度或加熱、攪拌等措施溶出率;
(2)H2O2是共價化合物,其電子式為![]() ,滴中過氧化氫的目的是為了將Fe2+氧化為Fe3+;
,滴中過氧化氫的目的是為了將Fe2+氧化為Fe3+;
(3)添加試劑X既能與H+反應,同時不引入雜質,則可選用MgO [Mg(OH)2 、MgCO3或Mg(OH)2CO3];
(4)向MgCl2溶液中滴加NaOH、NaClO的混合溶液,生成Mg2ClO(OH)3H2O,發生反應的化學方程式為NaClO+2MgCl2+3NaOH+H2O=Mg2ClO(OH)3H2O↓+4NaCl;開始加入氫氧化鈉或氫氧化鈉過量,會生成Mg(OH)2沉淀,故混合時NaOH溶液需最后加入且不能過量;
(5)堿式次氯酸鎂在酸性溶液中會生成HClO,能殺菌、漂白作用,發生反應的離子方程式為Mg2ClO(OH)3H2O+4H+ =2Mg2++HClO+4H2O;
(6)假設質量都是mg,Mg2ClO(OH)3H2O→Cl-得2個電子,Cl2→2Cl-得2個電子,所以Mg2ClO(OH)3H2O得到的電子的物質的量為![]() ×2=
×2=![]() mol,Cl2得到的電子的物質的量為
mol,Cl2得到的電子的物質的量為![]() ×2=
×2=![]() mol,所以
mol,所以![]() mol∶
mol∶![]() mol=0.42。
mol=0.42。


科目:高中化學 來源: 題型:
【題目】硅及其化合物在材料領域中應用廣泛.下列說法正確的是
A. 硅酸鈉可用于制備木材防火劑
B. 硅單質廣泛用于光纖通訊
C. 利用鹽酸刻蝕石英制作藝術品
D. 水晶項鏈是硅酸鹽制品
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學是一門以實驗為基礎,研究物質的組成、結構、性質及其變化規律的自然科學。學習科學研究的基本方法,可以加深對科學本質的認識,增進對物質世界的認識。下列有關敘述不正確的是

A. 用測定接近水的沸點的水蒸氣相對分子質量的方法可知水分子間可以形成氫鍵
B. 相對分子質量的測定常用質譜儀,在質譜儀內,有機化合物分子在高真空環境下被高能電子束轟擊后主要形成帶負電的碎片
C. 利用紅外光譜、核磁共振氫譜等現代物理方法或化學方法均可測定C2H6O的分子結構
D. 某有機物分子式為C11H14O2,其H—NMR圖譜如右圖(峰右側或上面的數字表示H的個數,且知:7.2ppm(5H)為苯基),可推測該有機物可能為
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業對國民經濟和社會發展具有重要的意義。對于一定體積密閉容器中的反應:N2(g)+3H2(g)![]() NH3(g)(正反應為放熱反應),673K、30MP下,n (NH3)和n (H2)隨時間t變化的關系如圖所示.下列敘述中,不正確的是()
NH3(g)(正反應為放熱反應),673K、30MP下,n (NH3)和n (H2)隨時間t變化的關系如圖所示.下列敘述中,不正確的是()

A. 點c處正反應速率比逆反應速率大 B. 點a的正反應速率比點b的正反應速率大
C. 氣體的平均摩爾質量:點b大于點a D. 混合氣體的密度:點b大于點a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知含銅離子的顏色主要有Cu(H2O)42+(藍色)、CuCl42(黃色)、Cu(NH3)42+(深藍色)等。
(1)16g銅在足量的氯氣中燃燒生成固體產物放出的熱量為56.8kJ。寫出銅在氯氣中燃燒的熱化學方程式為______________________________________。
(2)向氯化銅溶液中滴加氨水至過量,最終生成Cu(NH3)42+,觀察到的現象是________。
(3)CuCl2溶液中的銅主要以Cu(H2O)42+、CuCl42形式存在,將CuCl2溶于濃鹽酸中,存在下列平衡:Cu(H2O)42+ (aq)+4Cl (aq)![]() CuCl42 (aq)+4H2O(l) △H<0
CuCl42 (aq)+4H2O(l) △H<0
①該反應的平衡常數表達式為____________。
②常溫下,測定平衡體系中:Cu(H2O)42+濃度為a mol·L1、Cl濃度為b mol·L1、CuCl42濃度為c mol·L1,Cl的轉化率為____________(用含a、b、c的字母表示)。
③將c1 mol·L1CuCl2溶液和c2 mol·L1 HCl溶液等體積混合,測得混合溶液中c(Cl)與溫度T的關系如右圖所示。簡述溫度高于T1 K時,隨著溫度升高,c(Cl)增大的原因___________。

④用惰性電極電解濃度較大CuCl2溶液,陽極的電極反應式為_________________,當電解到一定程度,陰極附近出現藍色Cu(OH)2絮狀物。常溫下,經測定陰極附近溶液的pH=m,
此時陰極附近c(Cu2+)=___________ mol·L1 (已知:Cu(OH)2的Ksp=2.2×1020)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語表述一定正確的是
A.甲醛的電子式:![]()
B.苯酚鈉溶液中中通入少量二氧化碳氣體:![]()
C.溴乙烷與氫氧化鈉水溶液共熱:![]()
D.乙醇與灼熱的氧化銅反應:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有3個核酸分子,經分析共有5種堿基,8種核苷酸,4條多核苷酸鏈,它的組成是( )
A. 1個RNA、2個DNA B. 3個DNA
C. 1個DNA、2個RNA D. 3個RNA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】200℃時,11.6 g CO2和H2O的混合物氣體與足量的Na2O2反應,反應后固體增
加了3.6 g,則原混合氣體的平均式量為
A. 5.8 B. 11.6 C. 23.2 D. 46.4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com