
 贏在課堂名師課時計劃系列答案
贏在課堂名師課時計劃系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 元 素 | 有關信息 |
| A | 最高價氧化物對應的水化物(甲)能與其氣態氫化物(乙)反應生成鹽 |
| B | 地殼中含量最高的元素,A與B可形成一種質量比為 7:12的化合物(丙) |
| C | 單質曾用于焊接鋼軌 |
| D | 單質是生活中常見金屬,其制品在自然環境中被腐蝕呈現紅棕色 |
| ||
| ||
 容器中,反應過程中各物質的物質的量濃度c隨時間t的變化關系如圖所示.
容器中,反應過程中各物質的物質的量濃度c隨時間t的變化關系如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(15分)有關元素A.B.C.D的信息如下:
| 元 素 | 有關信息 |
| A | 最高價氧化物對應的水化物(甲)能與其氣態氫化物(乙)反應生成鹽 |
| B | 地殼中含量最高的元素,A與B可形成一種質量比為 7︰12的化合物(丙) |
| C | 單質曾用于焊接鋼軌 |
| D | 單質是生活中常見金屬,其制品在自然環境中被腐蝕呈現紅棕色 |
請回答下列問題:
(1)乙分子的空間構型________,用電子式表示乙的形成過程____________________。
(2)有關C與D元素,下列說法正確的是____________________ (填序號)。
①C或D的高價鹽均可用做凈水劑
②用C或D單質做成的槽車,都可用來運輸甲的稀溶液
③C、D的單質與稀硫酸組成的原電池,C電極發生氧化反應
④C的合金可用來做車船材料和門窗等
(3)B的一種氫化物在堿性溶液中可與丙反應,生成物中A元素只顯其最高價態,該反應的離子方程式是________________________________________。
(4)現取1 mol/L 100 mL的C的氯化物溶液,向其中加入1 mol/L氫氧化鈉溶液產生了3.9 g的沉淀,則加入的氫氧化鈉溶液體積可能是____________________mL。
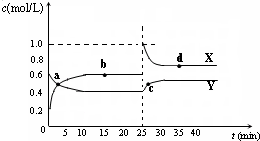
(5)已知:2AB2(g) A2B4(g);△H<0。在恒溫恒容條件下,將一定量AB2和A2B4的混合氣體通入容積為2L的密閉容器中,反應過程中各物質的物質的量濃度c隨時間t的變化關系如下圖所示。

① a、b、c、d四個點中,化學反應處于平衡狀態的是_______點。
② 25 min時,增加了_______(填物質的化學式)________mol。
③a、b、c、d四個點所表示的反應體系中,氣體顏色由深到淺的順序是_______(填字母)。
查看答案和解析>>
科目:高中化學 來源:2010年河北省唐山一中高三上學期期中考試化學卷 題型:填空題
(15分)有關元素A.B.C.D的信息如下:
| 元素 | 有關信息 |
| A | 最高價氧化物對應的水化物(甲)能與其氣態氫化物(乙)反應生成鹽 |
| B | 地殼中含量最高的元素,A與B可形成一種質量比為 7︰12的化合物(丙) |
| C | 單質曾用于焊接鋼軌 |
| D | 單質是生活中常見金屬,其制品在自然環境中被腐蝕呈現紅棕色 |
 可能是____________________mL。
可能是____________________mL。 A2B4(g);△H<0。在恒溫恒容條件下,將一定量AB2和A2B4的混合氣體通入容積為2L的密閉容器中,反應過程中各物質的物質的量濃度c隨時間t的變化關系如下圖所示。
A2B4(g);△H<0。在恒溫恒容條件下,將一定量AB2和A2B4的混合氣體通入容積為2L的密閉容器中,反應過程中各物質的物質的量濃度c隨時間t的變化關系如下圖所示。
 ① a、b、c、d四個點中,化學反應處于平衡狀態的是_______點。
① a、b、c、d四個點中,化學反應處于平衡狀態的是_______點。查看答案和解析>>
科目:高中化學 來源:2012-2013學年上海市四區(楊浦、青浦、寶山、靜安)高三下學期二模化學試卷(解析版) 題型:計算題
鐵鹽在工業、農業、醫藥等領域有重要的價值。
(1)將55.600g綠礬(FeSO4∙7H2O,式量為278)在高溫下加熱,充分反應后生成Fe2O3固體和SO2、SO3、水的混合氣體,則生成Fe2O3的質量為 g;SO2為 mol。
(2)實驗室可用以下方法制備摩爾鹽晶體[(NH4)2SO4·FeSO4·6H2O,式量為392]。
Ⅰ.將4.400g鐵屑(含Fe2O3)與25mL3mol/L H2SO4充分反應后,得到 FeSO4和H2SO4的混合溶液,稀釋溶液至100mL,測得其pH=1。
①鐵屑中Fe2O3的質量分數是 (保留兩位小數)。
Ⅱ.向上述100mL溶液中加入與該溶液中FeSO4等物質的量的(NH4)2SO4晶體,待晶體完全溶解后蒸發掉部分水,冷卻至t℃,析出摩爾鹽晶體12.360g,剩余溶液的質量為82.560g。
②t℃時,(NH4)2SO4·FeSO4·6H2O的溶解度是 g/100g水(保留兩位小數)。
(3)黃鐵礬是難溶于水且不含結晶水的鹽,它由兩種陽離子和兩種陰離子構成。工業上常用生成黃鐵礬的方法除去溶液中的Fe2+,原理是:用氧化劑將Fe2+氧化為Fe3+,Fe3+的水解產物與溶液中某些離子一起生成黃鐵礬沉淀。
實驗室模擬工業過程的操作如下:
向1L 0.0500mol/L的稀硫酸中加入16.680g綠礬,完全溶解后,依次加入1.065gNaClO3(式量106.5)和1.610gNa2SO4∙10H2O(式量322),充分反應后,得到9.700g黃鐵礬沉淀。所得無色溶液中含有的H+為0.16 mol,SO42—為0.075 mol,Cl—為0.01mol。
計算并確定黃鐵礬的化學式。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com