
堿式碳酸銅【Cu2(OH)2CO3】是一種用途廣泛的化工原料,實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:
步驟一:廢銅屑制硝酸銅
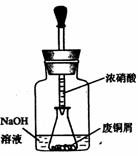
如圖,用膠頭滴管吸取濃HNO3緩慢加到錐形瓶內的廢銅屑中(廢銅屑過量),充分反應后過濾,得到硝酸銅溶液。
步驟二:堿式碳酸銅的制備
向大試管中加入碳酸鈉溶液和硝酸銅溶液,水浴加熱至70℃左右,用0.4 mol/L的NaOH溶液調節pH至8.5,振蕩,靜置,過濾,用熱水洗滌,烘干,得到堿式碳酸銅產品。
 完成下列填空:
完成下列填空:
35.寫出濃硝酸與銅反應的離子方程式。
36.上圖裝置中NaOH溶液的作用是__。反應結束后,廣口瓶內的溶液中,除了含有NaOH外,還有____(填寫化學式)。
37.步驟二中,水浴加熱所需儀器有____、__(加熱、夾持儀器、石棉網除外);洗滌的目的是____。
38.步驟二的濾液中可能含有CO32-,寫出檢驗CO32-的方法。
39.影響產品產量的主要因素有____。
40.若實驗得到2.42 g樣品(只含CuO雜質),取此樣品加熱至分解完全后,得到1.80 g固體,此樣品中堿式碳酸銅的質量分數是____。
【答案】35.Cu+4H++2NO3-→Cu2++2NO2↑+2H2O(2分)
36.吸收氮氧化物(合理即給分);NaNO3 、NaNO2 (2分)
37.燒杯、溫度計;除去產品表面吸附的硝酸鈉(3分)
38.取樣,加入稀鹽酸,將產生的氣體通入澄清石灰水,溶液變渾濁,說明有CO32-。(1分)
39.溫度、PH (2分) 40. 0.92(2分)
【解析】(36)廣口瓶內銅與濃硝酸反應生成大氣污染氣體NOx,NaOH溶液可用來吸收NOx,利用NO2+NaOH→NaNO2+NaNO3+H2O可知,反應結束后,廣口瓶的溶液中,除了剩余的NaOH外,還含有新生成的NaNO2與NaNO3。(37)因反應器為大試管,故水浴加熱中用來盛放水的儀器可以選用燒杯、溫度計(測定水溫);洗滌可除去堿式碳酸銅表面的吸附的硝酸鈉。(39)由步驟2可知實驗成功的關鍵是控制溶液PH和反應溫度,故影響產品質量的主要因素為溫度、PH。(40)堿式碳酸銅完全分解得到CuO,設樣品中堿式碳酸銅的質量分數為x,依據堿式碳酸銅的方程式,利用“差量法”可得:222:62=2.42x:(2.42-1.80),解得x=0.92。


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
(16分) 下圖中甲、乙、丙的電極材料都是石墨和鐵,其中丙是氯堿工業生產示意圖。
(1)若甲、乙兩燒杯均盛放CuSO4溶液,
①甲中鐵棒上的電極反應式為_______________________________________。
②乙裝置工作一段時間后,向燒杯中加入適量的堿式碳酸銅【Cu2(OH)2CO3】,能使溶液恢復到起始狀態,請寫出這段時間內乙裝置發生的所有反應的化學方程式
________________________________________________________________________。
(2)若甲、乙兩燒杯均盛放飽和NaCl溶液,
①甲中石墨棒上的電極反應式為___________________。
②將濕潤的淀粉碘化鉀試紙放在乙燒杯______(填“Fe”或“C”)電極的上方,發現試紙先變藍后褪色,這是因為過量的Cl2氧化了生成的I2。若反應物Cl2和I2的物質的量之比為5∶1,且生成兩種酸,則其對應的化學方程式為_________________________。
③假設產生的氣體全部逸出溶液,當乙反應有0.01 mol電子轉移后停止實驗,此時燒杯中溶液的體積為100 mL,則溶液混合均勻后的pH = ____________。
④當乙中的反應用于工業生產時,為了阻止兩極產物之間的反應,通常使用如丙圖所示的裝置,其中離子交換膜只允許Na+通過,Na+的移動方向如圖中標注,則H2的出口是________(填代號)。
查看答案和解析>>
科目:高中化學 來源:2013屆江西省上饒市橫峰中學高三第一次月考化學試卷(帶解析) 題型:實驗題
(本題共10分) 堿式碳酸銅【Cu2(OH)2CO3】是一種用途廣泛的化工原料,實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:
步驟一:廢銅屑制硝酸銅:如圖,用膠頭滴管吸取濃HNO3緩慢加到錐形瓶內的廢銅屑中(廢銅屑過量),充分反應后過濾,得到硝酸銅溶液。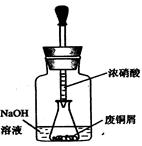
步驟二:堿式碳酸銅的制備:向大試管中加入碳酸鈉溶液和硝酸銅溶液,水浴加熱至70℃左右,用0.4 mol/L的NaOH溶液調節pH至8.5,振蕩,靜置,過濾,用熱水洗滌,烘干,得到堿式碳酸銅產品。
完成下列填空:
①.上圖裝置中NaOH溶液的作用是_ _。反應結束后,廣口瓶內的溶液中,除了含有NaOH外,還有__ __(填寫化學式)。
②步驟二中,水浴加熱所需儀器有__ __、_ _(加熱、夾持儀器、石棉網除外);
洗滌的目的是__ __。
③.步驟二的濾液中可能含有CO32-,寫出檢驗CO32-的方法。
④.若實驗得到2.42 g樣品(只含CuO雜質),取此樣品加熱至分解完全后,得到1.80 g固體,此樣品中堿式碳酸銅的質量分數是__ __。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年上海市楊浦區高三上學期期中考試化學試卷(解析版) 題型:實驗題
堿式碳酸銅【Cu2(OH)2CO3】是一種用途廣泛的化工原料,實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:
步驟一:廢銅屑制硝酸銅
如圖,用膠頭滴管吸取濃HNO3緩慢加到錐形瓶內的廢銅屑中(廢銅屑過量),充分反應后過濾,得到硝酸銅溶液。

步驟二:堿式碳酸銅的制備
向大試管中加入碳酸鈉溶液和硝酸銅溶液,水浴加熱至70℃左右,用0.4 mol/L的NaOH溶液調節pH至8.5,振蕩,靜置,過濾,用熱水洗滌,烘干,得到堿式碳酸銅產品。
完成下列填空:
(1)寫出濃硝酸與銅反應的離子方程式: 。
(2)上圖裝置中NaOH溶液的作用是_ 。反應結束后,廣口瓶內的溶液中,除了含有NaOH外,還有___ _(填寫化學式)。
(3)步驟二中,水浴加熱所需儀器有__ _、_ (加熱、夾持儀器、石棉網除外);
(4)步驟二的濾液中可能含有CO32-,寫出檢驗CO32-的方法:
(5)影響產品產量的主要因素有__ __。
(6)若實驗得到2.42 g樣品(只含CuO雜質),取此樣品加熱至分解完全后,得到1.80 g固體,此樣品中堿式碳酸銅的質量分數是___ _。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com