

| 電解質 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 開始沉淀時的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀時的pH | 6.4 | 9.6 | 4.0 |
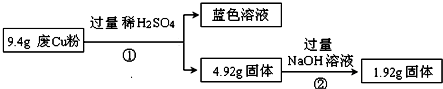
分析 過程Ⅰ:工業廢Cu粉(雜質含有SiO2、Al2O3、Fe2O3中的一種或幾種),由圖1可知,9.4gCu粉和過量稀硫酸反應生成藍色溶液,所以是銅離子的顏色,但是金屬Cu和鹽酸不反應,所以一定含有氧化鐵,和鹽酸反應生成的三價鐵離子可以和金屬銅反應,二氧化硅可以和氫氧化鈉反應,4.92g固體和氫氧化鈉反應后,固體質量減少了3.0g,所以該固體為二氧化硅,質量為3.0g,涉及的反應有:Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+、SiO2+2NaOH=Na2SiO3+H2O,又Cu與NaOH不反應,1.92g固體只含Cu;
過程Ⅱ:由圖可知,9.4gX與過量的氫氧化鈉溶液反應后得到6.4g不溶物,固體部分溶解,原固體中至少含有Al2O3、SiO2的一種物質;6.4g固體與過量的稀硫酸反應得到藍色溶液,藍色溶液中存在銅離子,發生了反應:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,說明溶液中一定存在Fe2+、H+、Cu2+,1.92g固體為銅,以此來解答;
(4)Ⅱ中所得藍色溶液存在Fe2+、H+、Cu2+,向其中加入一定量的H2O2 溶液,發生氧化還原反應,亞鐵離子被氧化成鐵離子,調節pH值,使鐵離子沉淀完全,根據表中的數據判斷pH值;
A.H2O2被還原后生成水,是綠色氧化劑,在氧化過程中不引進雜質、不產生污染;
B.將Fe2+氧化為Fe3+的主要原因是Fe(OH)2完全沉淀時的pH是9.6,而Fe(OH)3完全沉淀時的pH為4.0,據此判斷;
C.調節溶液pH選擇的試劑要能與硫酸反應且不引入新雜質,溶液中的溶質主要是硫酸銅,據此判斷;
D.根據表中的數據可知,在pH>4的溶液中Fe3+已經沉淀完全.
解答 解:過程Ⅰ:工業廢Cu粉(雜質含有SiO2、Al2O3、Fe2O3中的一種或幾種),由圖1可知,9.4gCu粉和過量稀硫酸反應生成藍色溶液,所以是銅離子的顏色,但是金屬Cu和鹽酸不反應,所以一定含有氧化鐵,和鹽酸反應生成的三價鐵離子可以和金屬銅反應,二氧化硅可以和氫氧化鈉反應,4.92g固體和氫氧化鈉反應后,固體質量減少了3.0g,所以該固體為二氧化硅,質量為3.0g,涉及的反應有:Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+、SiO2+2NaOH=Na2SiO3+H2O,又Cu與NaOH不反應,1.92g固體只含Cu,
(1)根據上面的分析,廢Cu粉中一定含有的雜質是 Fe2O3、SiO2,
故答案為:Fe2O3、SiO2;
(2)由I可知X中一定存在的是Cu、Fe2O3、Al2O3,離子方程式分別為Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,③涉及反應有SiO2+2OH-═SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O,
故答案為:Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;SiO2+2OH-═SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O;
過程Ⅱ:由圖可知,9.4gX與過量的氫氧化鈉溶液反應后得到6.4g不溶物,固體部分溶解,原固體中至少含有Al2O3、SiO2的一種物質;6.4g固體與過量的稀硫酸反應得到藍色溶液,藍色溶液中存在銅離子,發生了反應:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,總反應為Fe2O3+6H++Cu═2Fe2++Cu2++3H2O,根據該反應可知,參加反應的,未溶解的1.92g固體為銅,
(3)由第一個流程可知二氧化硅的質量為3.0g,第二個流程中9.4gX與過量的氫氧化鈉溶液反應后得到6.4g不溶物,固體質量減少3g,則原固體中只含有SiO2,沒有Al2O3,
則Fe2O3、Cu一共6.4g,設Fe2O3為xmol,Cu為ymol,
則160x+64y=6.4
Fe2O3+6H++Cu═2Fe2++Cu2++3H2O,
xmol xmol 2xmol xmol
則反應剩余的Cu為:(y-x)mol×64g/mol=1.92g,
解得:x=0.02,y=0.05,
則Fe2O3的質量為0.02mol×160g/mol=3.2g,
Cu的質量為0.05mol×64g/mol=3.2g,
原混合物中各成分的質量之比m(Fe2O3):m(Cu):m(SiO2)=3.2:3.2:3.0=16:16:15,
故答案為:m(Fe2O3):m(Cu):m(SiO2)=16:16:15;
(4)Ⅱ中所得藍色溶液存在Fe2+、H+、Cu2+,向其中加入一定量的H2O2 溶液,發生氧化還原反應,亞鐵離子被氧化成鐵離子,調節pH值,使鐵離子沉淀完全,根據表中的數據可知,當pH值為4.0時,鐵離子沉淀完全,當pH值為5.4時,銅離子開始沉淀,所以要使得鐵離子完全沉淀,而銅離子不能沉淀,調節pH值為4.0≤pH<5.4,
故答案為發:4.0≤pH<5.4;
A.H2O2被還原后生成水,是綠色氧化劑,在氧化過程中不引進雜質、不產生污染,故A正確;
B.將Fe2+氧化為Fe3+的主要原因是Fe(OH)2完全沉淀時的pH是9.6,而Fe(OH)3完全沉淀時的pH為4.0,故B錯誤;
C.調節溶液pH選擇的試劑要能與硫酸反應且不引入新雜質,溶液中的溶質主要是硫酸銅,故C正確;
D.根據表中的數據可知,在pH>4的溶液中Fe3+已經沉淀完全,故D正確,
故選ACD.
點評 本題考查物質分離提純的綜合應用,側重于學生的分析和實驗能力的考查,為高考常見題型和高頻考點,注意掌握檢驗未知物的常用方法,能夠根據反應現象判斷存在的物質,注意合理分析題中數據,根據題中數據及反應方程式計算出銅和氧化鐵的質量,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用濕潤的pH試紙測稀堿液的pH值,測定值偏小 | |
| B. | 用容量瓶配制溶液,定容時仰視刻度線,所配溶液濃度偏大 | |
| C. | 用鹽酸標準溶液滴定未知濃度的NaOH溶液時,若滴定前滴定管內無氣泡,終點讀數時有氣泡,則所測NaOH溶液的濃度偏大 | |
| D. | 測定中和反應的反應熱時,將堿緩慢倒入酸中,所測溫度值偏高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.30 | B. | 0.35 | C. | 0.40 | D. | 0.50 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
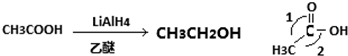
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
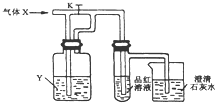
| A. | X是SO2,Y是飽和NaHCO3 溶液 | B. | X是H2S,Y是濃H2SO4 | ||
| C. | X是CO2,Y是Na2SO3 溶液 | D. | X是Cl2,Y是Na2CO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl-、K+、HCO3-、Ca2+ | B. | OH-、NH4+、Mg2+、HCO3- | ||
| C. | SO32-、H+、Cl-、NO3- | D. | Na+、SiO32-、H+、Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com