
亞磷酸(H3PO3)是二元酸,H3PO3溶液存在電離平衡:H3PO3  H+ + H2PO3-。亞磷酸與足量NaOH溶液反應,生成Na2HPO3。
H+ + H2PO3-。亞磷酸與足量NaOH溶液反應,生成Na2HPO3。
(1)①寫出亞磷酸與少量NaOH溶液反應的離子方程式____________________________。
②某溫度下,0.1000 mol·L-1的H3PO3溶液pH的讀數為1.6,即此時溶液中c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他離子的濃度由小到大的順序是 ,該溫度下H3PO3電離平衡的平衡常數K= 。(H3PO3第二步電離忽略不計,結果保留兩位有效數字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亞磷酸具有強還原性,可使碘水褪色,該反應的化學方程式_______________________。
(3)電解Na2HPO3溶液也可得到亞磷酸,裝置示意圖如下: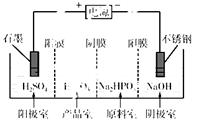
說明:陽膜只允許陽離子通過,陰膜只允許陰離子通過。
①陰極的電極反應式為________________________。
②產品室中反應的離子方程式為________________。
(1) ①H3PO3+OH-=H2PO3-+H2O (2分)
②c(HPO32-)<c(H2PO3-)<c(H+) (2分) 8.3×10-3mol/L(2分,寫或不寫單位均正確)
③ = (2分)
(2)H3PO3+I2+H2O=H3PO4+2HI(2分)
(3)①2H++2e-=H2↑ (2分)
②HPO32-+2H+=H3PO3(2分) 或HPO32-+H+=H2PO3-、H2PO3-+H+=H3PO3(各1分)
解析考點分析:(1)①亞磷酸是二元酸,亞磷酸和少量氫氧化鈉反應生成NaH2PO3、H2O,所以該反應方程式為:H3PO3+OH-=H2PO3-+H2O,故答案為:H3PO3+OH-=H2PO3-+H2O;
②0.1000mol?L-1的H3PO3溶液pH的讀數為1.6,氫離子濃度小于亞磷酸濃度,所以亞磷酸是二元弱酸,在水中分步電離,且第一步電離程度大于第二步,兩步電離中都有氫離子生成,所以氫離子濃度最大,離子濃度大小順序是c(HPO32-)<c(H2PO3-)<c(H+),
H3PO3  H++H2PO3-
H++H2PO3-
起始時各物質濃度(mol?L-1) 0.10 0 0
反應的各物質的濃度(mol?L-1)2.5×10-2 2.5×10-2 2.5×10-2
平衡時各物質的濃度(mol?L-1)0.10-2.5×10-2 2.5×10-22.5×10-2
K=c(H+)c(H2PO3?)/c(c(H3PO3)=2.5×10?2×2.5×10?2/0.10-2.5×10?2=8.3×10-3mol/L;
故答案為:c(HPO32-)<c(H2PO3-)<c(H+),8.3×10-3mol/L;
③溶液呈中性,則C(H+)=C(OH-),溶液呈電中性,則c(Na+)+C(H+)=C(OH-)+c(H2PO3-)+2c(HPO32-),因為C(H+)=C(OH-),所以c(Na+)=c(H2PO3-)+2c(HPO32-),故答案為:=;
(2)碘具有強氧化性,亞磷酸具有強還原性,所以亞磷酸和碘能發生氧化還原反應生成氫碘酸和磷酸,反應方程式為:H3PO3+I2+H2O=2HI+H3PO4,故答案為:H3PO3+I2+H2O=2HI+H3PO4;
(3)①陰極上氫離子得電子發生還原反應,電極反應式為2H++2e-=H2↑,故答案為:2H++2e-=H2↑;
②產品室中HPO32-和氫離子結合生成亞磷酸,反應離子方程式為:HPO32-+2H+=H3PO3,故答案為:HPO32-+2H+=H3PO3.
考點:弱電解質的電離、電極反應式的書寫、有關平衡常數的計算。


科目:高中化學 來源: 題型:填空題
請回答有關滴定過程中的相關問題。
(1)用已知濃度的氫氧化鈉溶液滴定未知濃度的鹽酸,滴定曲線如圖所示。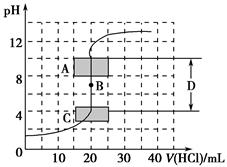
①在圖中A的pH范圍使用的指示劑是________;
C的pH范圍使用的指示劑是________。
②下列關于上述中和滴定過程中的操作,正確的是________(填序號)。
| A.用堿式滴定管量取已知濃度的燒堿溶液 |
| B.滴定管和錐形瓶都必須用待裝液潤洗 |
| C.滴定過程中始終注視錐形瓶中溶液顏色變化 |
| D.錐形瓶中的待測液可用量筒量取 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某化工廠的含鎳廢催化劑主要含Ni,還含有Al、Al2O3、Fe、FeO、Fe2O3及其他不溶雜質(其他不溶雜質不與酸堿反應)。某校化學研究性學習小組設計了如下圖所示的方法,以該含鎳廢催化劑為原料來制備NiSO4·7H2O。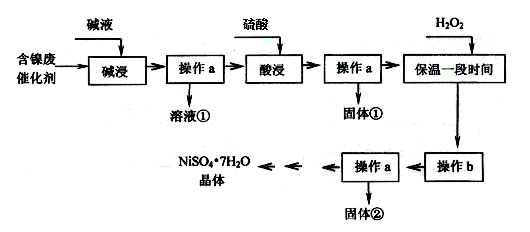
【查閱資料】
①Ni能與非氧化性酸反應生成Ni2+,不與堿液反應。
②部分陽離子以氫氧化物形式沉淀時pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 開始沉淀的pH | 4.1 | 1.7 | 7.6 | 7.0 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.5 | 9.2 |
 2Ni(OH)2,寫出該反應放電時正極反應式 。
2Ni(OH)2,寫出該反應放電時正極反應式 。 。
。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)25 ℃時,0.1 mol·L-1NaOH溶液的pH為________;
(2)25 ℃時,0.1 mol·L-1NH4Cl溶液的pH_____7(填“<”、“=”或“>”),其原因是_________(用離子方程式表示);
(3)將上述兩種溶液等體積混合后,離子濃度大小次序正確的是________(填序號)。
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4) 下列物質能導電且屬于電解質的是________(填序號)。
A.鐵 B.鹽酸 C.氯化鈉晶體 D.熔融氫氧化鈉
(5) 25℃時,0.1 mol·L-1NaOH溶液中水電離出來的氫氧根的濃度為C1,0.1 mol·L-1NH4Cl溶液中水電離出來的氫離子的濃度為C2,則C1 ______C2(填“<”、“=”或“>”)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上設計將VOSO4中的K2SO4、SiO2雜質除去并回收得到V2O5的流程如下: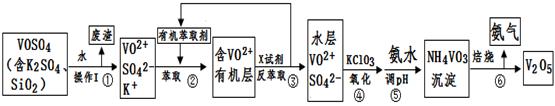
請回答下列問題:
(1)步驟①所得廢渣的成分是 (寫化學式),操作I的名稱 。
(2)步驟②、③的變化過程可簡化為(下式R表示VO2+,HA表示有機萃取劑):
R2(SO4)n (水層)+ 2nHA(有機層) 2RAn(有機層) + nH2SO4 (水層)
2RAn(有機層) + nH2SO4 (水層)
②中萃取時必須加入適量堿,其原因是 。③中X試劑為 。
(3)⑤的離子方程式為 。
(4)25℃時,取樣進行試驗分析,得到釩沉淀率和溶液pH之間關系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 釩沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)pH=13的CH3COONa溶液加水稀釋100倍后,pH 11(填“>”“=”或“<”),原因是 (用離子方程式和必要的文字說明);pH相等的NaOH溶液與CH3COONa溶液,分別加熱到相同的溫度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等時,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三種溶液中c(NH4+)由大到小的順序為 ;
(3)等體積、等濃度的氫氧化鈉與醋酸混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)(填“>”“=”或“<”);pH=13的氫氧化鈉與pH=1的醋酸等體積混合后溶液呈 性,溶液中c(Na+)
c(CH3COO-)(填“>”“=”或“<”);
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲線如圖。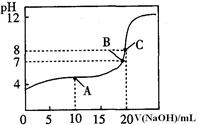
①為減小實驗誤差,由圖可知滴定時指示劑應選用 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三點所示溶液導電能力最強的是 點對應的溶液;
③25OC,HA的電離平衡常數約為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)①pH= a的CH3COOH溶液稀釋100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固體是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的兩種混合而成。取該固體溶于水得到無色澄清溶液,向該溶液中加入稀硫酸,有白色沉淀生成,繼續加入稀硫酸,沉淀又完全消失,且整個過程中無氣體產生。則 原固體中含有物質有 和 。(寫化學式)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知MOH為一元弱堿,25℃時,電離常數Kb= 1×10- 6mol·L-1,
(1)25℃時,將0.2 mol·L-1 HCl溶液與0.2 mol·L-1 MOH溶液等體積混合(忽略混合后溶液體積的變化),測得混合溶液的pH=6,此時混合溶液中由水電離出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水電離出的c(H+)=Bmol·L-1,則:
①比較A B。(填“>”、“<”或“=”)
②根據電荷守恒,計算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精確計算,填具體數字)
(2)25℃時,0.01 mol·L-1MOH溶液的 pH=10,將其與等體積 pH = 4的鹽酸溶液混合,則混合溶液的pH 7(填“>”、“<”或“=”),試求此時溶液中M Cl的水解平衡常數Kh= mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某硫酸工廠的酸性廢水中砷(As)元素含量極高,為控制砷的排放,采用化學沉降法處理含砷廢水,工藝流程如下:
相關數據如下表,請回答以下問題:
表1.幾種鹽的Ksp
| 難溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 廢水濃度 | 29.4g/L | 1.6g·L-1 |
| 排放標準 | pH 6~9 | 0.5mg·L-1 |
 HAsO42-+OH-,該步水解的平衡常數(25℃)為: (保留兩位有效數字)。
HAsO42-+OH-,該步水解的平衡常數(25℃)為: (保留兩位有效數字)。查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com