
(8 分)目前,汽車尾氣已成為許多大城市空氣的主要污染。汽車尾氣中含 有 CO、NO 等多種污染物。
( 1)汽 車 燃 料 中 一 般 不 含 氮 , 尾 氣 中 所 含 的NO 產 生 的 原 因是 ,化學方程式為 。
(2)治理汽車尾氣中 NO和 CO的一種方法是:在汽車的排氣管上裝上一個催 化轉化裝置,使 NO 和 CO反應,生成 CO2和N2。反應的化學方程式為 。
(3)下列措施中,能減少或控制汽車尾氣污染有效且可行的是 。
① 制定嚴格的尾氣排放標準,并嚴格執行。
② 開發清潔能源,如氫能汽車、 太陽能汽車等。
③ 市民出行帶防毒面具。
④ 市民大量移居城市郊區。
科目:高中化學 來源:2016屆湖南省高三上學期入學考試化學試卷(解析版) 題型:選擇題
給定條件下,下列選項中所示的物質間轉化均能一步實現的是
A.粗硅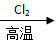 SiCl4
SiCl4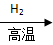 Si
Si
B.Mg(OH)2 MgCl2(aq)
MgCl2(aq) 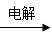 Mg
Mg
C.Fe2O3 FeCl3(aq)
FeCl3(aq) 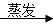 無水FeCl3
無水FeCl3
D.AgNO3(aq) 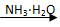 [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq) 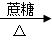 Ag
Ag
查看答案和解析>>
科目:高中化學 來源:2016屆四川省高三上學期第一次月考化學試卷(解析版) 題型:填空題
(14分)丙烷在燃燒時能放出大量的熱,它也是液化石油氣的主要成分,作為能源應用于人們的日常生產和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O (l)△H1=﹣2741.8kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=﹣566kJ/mol
(1)反應C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) 的△H= 。
(2)現有1mol C3H8在不足量的氧氣里燃燒,生成1mol CO和2mol CO2以及氣態水,將所有的產物通入一個固定體積為1L的密閉容器中,在一定條件下發生如下可逆反應:CO(g)+H2O(g) CO2(g)+H2(g)△H=+41.2kJ/mol
CO2(g)+H2(g)△H=+41.2kJ/mol
①下列事實能說明該反應達到平衡的是 。
a.體系中的壓強不發生變化
b.V正(H2)=V 逆(CO)
c.混合氣體的平均相對分子質量不發生變化
d.CO2的濃度不再發生變化
②5min后體系達到平衡,經測定,H2為0.8mol,則v(H2O)= ;此時該反應的平衡常數K為 。
③向平衡體系中充入少量CO則平衡常數K (填“增大”、“減小”或“不變”)
依據(1)中的反應可以設計一種新型燃料電池,一極通入空氣,另一極通入丙烷氣體;燃料電池內部是熔融的摻雜著氧化釔(Y2O3)的氧化鋯(ZrO2)晶體,在其內部可以傳導O2﹣,電池內部O2﹣由 極移向 極(填“正”或“負”);電池的負極電極反應式為 。
(3)用上述燃料電池和惰性電極電解足量Mg(NO3)2和NaCl的混合溶液.電解開始后陰極區的現象為 。
查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三上學期一模化學試卷(解析版) 題型:選擇題
下列關于金屬鈉的敘述錯誤的是
A.金屬鈉可以保存在煤油中
B.金屬鈉著火時,可用泡沫滅火器來滅火
C.鈉與熔融的四氯化鈦反應可制取鈦
D.實驗時用剩的鈉塊應該放回原試劑瓶
查看答案和解析>>
科目:高中化學 來源:2014-2015學年廣東省佛山市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下列離子方程式書寫正確的是
A.三氯化鐵溶液中加入鐵粉:Fe3+ + Fe ═ 2Fe2+
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH— ═ Al(OH)3↓
C.苯酚鈉溶液中通入少量CO2:CO2 + H2O + C6H5O- → C6H5OH + HCO3-
D.用濃鹽酸與MnO2反應制取少量氯氣:MnO2+4H++4Cl— = Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化學 來源:2015-2016學年青海省高一入學化學試卷(解析版) 題型:選擇題
下列物質不能通過化合反應生成的是
A.NaOH B.NaHCO3 C.FeCl2 D.Al(OH)3
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西省太原市高一上入學考試化學試卷(解析版) 題型:選擇題
下列變化屬于化學變化的是( )
A、礦石粉碎 B、電燈發光 C、冰棒融化 D、食物腐爛
查看答案和解析>>
科目:高中化學 來源:2016屆安徽省等六校教研會高三第一次聯考化學試卷(解析版) 題型:填空題
氨氣是一種重要的化工產品,工業上可以按照下圖所示流程生產氨氣:
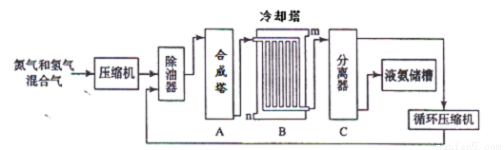
(1)原料氣之一氮氣的工業制取方法是 ,寫出氨氣的工業用途(任答一點) 。
(2)寫出合成塔中發生的反應的化學反應方程式 。在冷卻塔中對混合氣體進行冷卻,冷水的入口 (答m或n)。
(3)設備C的作用 。其分離器中的過程對整個工業合成氨的意義 (試結合平衡移動原理回答)。
(4)在原料氣制備過程中混有 CO對催化劑有毒害作用,欲除去原料氣中的 CO,可通過如下反應來實現:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K時該反應的平衡常數K=0.627,若要使CO的轉化超過80%,則起始物中c(H2O):c(CO)不低于 (精確到小數點后一位)。
CO2 (g)+ H2 (g),已知1000K時該反應的平衡常數K=0.627,若要使CO的轉化超過80%,則起始物中c(H2O):c(CO)不低于 (精確到小數點后一位)。
查看答案和解析>>
科目:高中化學 來源:2016屆江西省三校高三上第一次聯考化學試卷(解析版) 題型:選擇題
下列實驗能達到預期目的的是
編號 | 實驗內容 | 實驗目的 |
A | 室溫下,用pH試紙分別測定濃度為0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比較HClO和CH3COOH的酸性強弱 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固體,溶液紅色變淺 | 證明Na2CO3溶液中存在水解平衡 |
C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,產生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成紅褐色沉淀 | 證明在相同溫度下的Ksp: Mg(OH)2 >Fe(OH)3 |
D | 分別測定室溫下等物質的量濃度的Na2SO3與Na2CO3溶液的pH,后者較大 | 證明非金屬性S>C |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com