
【題目】下圖Ⅰ、Ⅱ、Ⅲ是常見的氣體發生裝置;Ⅳ、Ⅴ、Ⅵ是氣體收集裝置,根據要求回答下列問題:
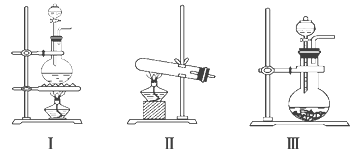
(1)若用MnO2與濃鹽酸反應制取氯氣,應選用發生裝置_____,用方程式表示制取氯氣的反應原理是______。
(2)若用KMnO4與濃鹽酸反應制取氯氣,試完成并配平下列離子方程式:
____MnO42-+____Cl-+____H+===____Mn2++____Cl2↑+____________。
(3)若選用Ⅳ為氯氣的收集裝置,應該在試管口放置一團棉花,該棉花團應用________溶液浸濕,其作用是____________。
(4)若選用Ⅴ為氯氣收集裝置,則氯氣應從__________口通入。用化學方法檢驗氯氣收集滿了的方法是_______。
(5)科學家經研究發現NaClO2可用于制取自來水消毒劑ClO2。在一定條件下,將Cl2通入填充有固體NaClO2的反應柱內二者反應可制得ClO2。還原產物為_____,當消耗標準狀況下1.12L Cl2 時,制得ClO2_____g。
【答案】Ⅰ MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O 2 10 16 2 5 8H2O 氫氧化鈉 防止氯氣逸出污染空氣 A 將濕潤的淀粉KI試紙放在B口處,試紙變藍色,證明氯氣已集滿 NaCl 6.75
MnCl2+Cl2↑+2H2O 2 10 16 2 5 8H2O 氫氧化鈉 防止氯氣逸出污染空氣 A 將濕潤的淀粉KI試紙放在B口處,試紙變藍色,證明氯氣已集滿 NaCl 6.75
【解析】
(1)根據反應物的狀態及反應條件確定反應裝置;二氧化錳和濃鹽酸反應生成氯化錳、氯氣和水,注意二氧化錳和濃鹽酸反應但不與稀鹽酸反應;
(2)分析反應中元素化合價變化,依據氧化還原反應得失電子守恒、原子個數守恒配平方程式;
(3)氯氣有毒,直接排放能夠引起空氣污染,氯氣能夠與堿反應可以用氫氧化鈉溶液吸收;
(4)氯氣密度大于空氣密度,應選擇向上排氣法收集,氯氣具有氧化性能氧化碘離子生成單質碘;
(5)得到電子的元素生成的物質是還原產物,根據元素的化合價變化計算。
(1)二氧化錳和濃鹽酸的反應是固液混合加熱型,所以選擇Ⅰ裝置;在加熱條件下,二氧化錳和濃鹽酸反應生成氯化錳、氯氣和水,反應的方程式為MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)高錳酸鉀與濃鹽酸不需要加熱即可制備氯氣,反應中KMnO4→MnCl2,Mn元素化合價由+7降低為+2,共降低5價,HCl(濃)→Cl2,Cl元素化合價由-1價升高為0價,共升高為2價,化合價升降最小公倍數為10,故KMnO4的系數為2,Cl2的系數為5,再根據原子守恒配平其它物質的系數,配平后的方程式為2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)氯氣有毒,直接排放能夠引起空氣污染,氯氣能夠與堿反應可以用氫氧化鈉溶液吸收,所以若選用Ⅳ為氯氣的收集裝置,應該在試管口放置一團棉花,該棉花團應用氫氧化鈉溶液浸濕,其作用是吸收過量氯氣,防止空氣污染;
(4)氯氣密度大于空氣密度,應選擇向上排氣法收集,若選用Ⅴ為氯氣收集裝置,應長進短出,即從A口入;氯氣具有氧化性能氧化碘離子生成單質碘,碘遇到淀粉變藍,所以可以用濕潤的淀粉碘化鉀試紙檢驗,即將濕潤的淀粉KI試紙放在B口處,試紙變藍色,證明氯氣已集滿;
(5)反應物氯氣中氯元素化合價從0價降低到-1價,得到1個電子,氯氣是氧化劑,所以還原產物是NaCl。NaClO2中氯元素化合價從+3價升高到+4價,失去1個電子,因此當消耗標準狀況下1.12L Cl2即0.05mol時,根據電子得失守恒可知可制得ClO2的質量是0.05mol×2×67.5g/mol=6.75g。


科目:高中化學 來源: 題型:
【題目】儲氫納米碳管的研究成功體現了科技的進步,但用電弧法合成的碳納米管常伴有大量的雜質——碳納米顆粒,這種碳納米顆粒可用氧化氣化法提純。其反應式為:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)請用雙線橋法標出電子轉移方向和數目________________________________。
(2)上述反應中氧化劑是______(填化學式),被氧化的元素是________(填元素符號)。
(3)H2SO4 在上述反應中表現出來的性質是____________(填序號)。
A.氧化性 B.氧化性和酸性 C.酸性 D.還原性和酸性
(4)若反應中電子轉移了0.8 mol,則產生的氣體在標準狀況下的體積為_________L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組研究NaClO溶液與KI溶液的反應,實驗記錄如下:
實驗編號 | 實驗操作 | 實驗現象 |
Ⅰ |
| ⅰ.溶液變為淺黃色 ⅱ.溶液變藍 |
Ⅱ |
| ⅰ.溶液保持無色 ⅱ.溶液不變藍,溶液的pH=10 |
【資料】:碘的化合物主要以I和IO3的形式存在。酸性條件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加熱的條件下極不穩定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用離子方程式表示其原因:______。
(2)實驗Ⅰ中溶液變為淺黃色的離子方程式是______。
(3)對比實驗Ⅰ和Ⅱ,研究實驗Ⅱ反應后“溶液不變藍”的原因。
① 提出假設a:I2在堿性溶液中不能存在。設計實驗Ⅲ證實了假設a成立,實驗Ⅲ的操作及現象是______。
② 進一步提出假設b:NaClO可將I2氧化為IO3。進行實驗證實了假設b成立,裝置如下圖,其中甲溶液是______,實驗現象是______。

(4)檢驗實驗Ⅱ所得溶液中的IO3:
取實驗Ⅱ所得溶液,滴加稀硫酸至過量,整個過程均未出現藍色,一段時間后有黃綠色刺激性氣味的氣體產生,測得溶液的pH=2。再加入KI溶液,溶液變藍,說明實驗Ⅱ所得溶液中存在IO3。
① 產生的黃綠色氣體是______。
② 有同學認為此實驗不能說明實驗Ⅱ所得溶液中存在IO3,理由是______。欲證明實驗Ⅱ所得溶液中存在IO3,改進的實驗方案是______。
③ 實驗Ⅱ中反應的離子方程式是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
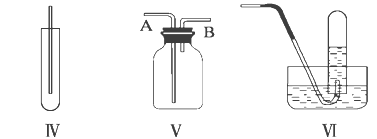
【題目】聚氨酯類高分子材料PU用途廣泛,其合成反應為:
下列說法不正確的是
A. HO(CH2)4OH的沸點高于CH3CH2CH2CH3
B. 高分子材料PU在強酸、強堿中能穩定存在
C. 合成PU的兩種單體的核磁共振氫譜中均有3個吸收峰
D. 以1,3-丁二烯為原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與人類生活密切相關。請按要求,回答下列問題:
(1)K2FeO4是一種重要的凈水劑,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH ![]() 2K2FeO4+6KCl+8H2O。在該反應中,還原劑是_____,當反應中有1mol K2FeO4生成時,消耗Cl2在標況下的體積為_________ L,轉移電子的數目為_____。
2K2FeO4+6KCl+8H2O。在該反應中,還原劑是_____,當反應中有1mol K2FeO4生成時,消耗Cl2在標況下的體積為_________ L,轉移電子的數目為_____。
(2)宇航員常用過氧化鈉作供氧劑,寫出過氧化鈉與二氧化碳反應的化學方程式并用雙線橋法表示電子轉移的方向和數目:_____________________________________________。
(3)廚房里小蘇打常作面包和糕點的發泡劑,寫出小蘇打溶于水的電離方程式:___________。
(4)工業上制漂白粉的化學方程式為_______________________________,新制氯水在陽光照射下產生無色氣體,該反應的化學方程式是______。
(5)KA1(SO4)212H2O因其溶于水生成_____(化學式)可以吸附雜質,從而達到凈水作用。
(6)硅鋼具有很高的_____,主要用作變壓器的鐵芯;硅酸鈉水溶液的俗名為______,可作為木材________________的原料。
(7)電子工業常用30%的FeCl3溶液腐蝕敷在絕緣板上的銅箔來制造印刷電路板。寫出FeCl3溶液與銅發生反應的離子方程式:________________________________。若向盛有氯化鐵溶液的燒杯中同時加入鐵粉和銅粉,反應結束后,下列結果不可能出現的是________。
A.有銅無鐵 B.有鐵無銅 C.鐵、銅都有 D.鐵、銅都無
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中,當反應aA(g) ![]() bB(g)+cC(g)達到平衡后,保持溫度不變,將容器體積增加一倍,最終測得A的物質的量的濃度為原來的55%,則
bB(g)+cC(g)達到平衡后,保持溫度不變,將容器體積增加一倍,最終測得A的物質的量的濃度為原來的55%,則
A. 平衡向正反應方向移動 B. a>b+c
C. 物質B的質量分數增大 D. 以上判斷都錯誤
查看答案和解析>>
科目:高中化學 來源: 題型:
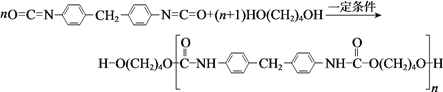
【題目】硼酸三甲酯用作檸檬類水果的熏蒸劑。實驗室合成硼酸三甲酯的原理及裝置如下:
硼酸三甲酯 | 甲醇 | |
溶解性 | 與乙醚、甲醇混溶,能水解 | 與水混溶 |
沸點/℃ | 68 | 64 |
硼酸三甲酯與甲醇混合物的共沸點為54℃ | ||
Na2B4O7·10H2O+2H2SO4+16CH3OH![]() 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
實驗步驟如下:
①在圓底燒瓶中加入44.8g甲醇和19.1gNa2B4O7·10H2O (硼砂,式量為382),然后緩慢加入濃H2SO4并振蕩;加熱燒瓶中的液體;通過分餾柱回流一段時間。
②先接收51~55℃的餾分,再接收55~60℃的餾分。
③將兩次餾分合并,加入氯化鈣進行鹽析分層,上層為硼酸三甲酯,分離。
④精餾得高純硼酸三甲酯19.2g。
回答下列問題:
(1)圖中儀器a的名稱為____________;直形冷凝管冷卻水應從____________(填“b”或“c”)接口進入。
(2)本實驗加熱方式為____________,優點是____________。
(3)加入氯化鈣鹽析分層的主要目的是____________。
(4)U型管中P2O5的作用是_____________________________________。
(5)步驟④的儀器選擇及安裝都正確的是____________ (填標號),應收集____________℃的餾分。


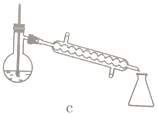
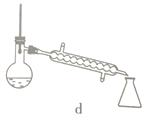
(6)本次實驗的產率是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com