
科目:高中化學 來源: 題型:
蛇紋石礦可看作由MgO、Fe2O3、Al2O3、SiO2組成.由蛇紋石制堿式碳酸鎂的實驗步驟如下: 室溫下,相關金屬氫氧化物沉淀的KSP見下表1
|
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化學 來源: 題型:
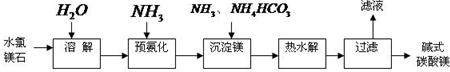
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com