

分析 含鎳(Ni2+)廢液為原料生產NiOOH,在含Ni+的廢液中中加入碳酸鈉溶液,過濾得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入試劑調節溶液的pH使鎳離子全部沉淀生成Ni(OH)2,在空氣中加熱Ni(OH)2制取NiOOH,
(1)確認Ni2+已經完全沉淀的實驗方法是取上層清液,加入碳酸鈉溶液觀察是否有沉淀生成,判斷鎳離子是否全部沉淀,過濾用到的玻璃儀器有燒杯、漏斗、琉璃棒;
(2)碳酸鎳與稀硫酸反應生成硫酸鎳、二氧化碳、水,根據電荷守恒和元素守恒可寫出反應的離子方程式;
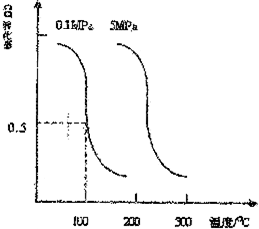
(3)合成氨的相對初始速率隨催化劑中n值增大而增大,而n增大,Co2+的比例增大;
(4)空氣中加熱Ni(OH)2和空氣中氧氣反應生成NiOOH和水;
(5)消耗KMnO4物質的量:0.01 mol•L-1×0.01L=1×10-4mol,根據電子得失守恒可知Ni(OH)2的物質的量為5×10-4mol,可計算得混合物中Ni(OH)2的質量,再計算出NiOOH的質量,確定NiOOH的物質的量,依據xNiOOH•yNi(OH)2計算x和y的比值.
解答 解:含鎳(Ni2+)廢液為原料生產NiOOH,在含Ni+的廢液中中加入碳酸鈉溶液,過濾得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入試劑調節溶液的pH使鎳離子全部沉淀生成Ni(OH)2,在空氣中加熱Ni(OH)2制取NiOOH,
(1)確認Ni2+已經完全沉淀的實驗方法是取上層清液,加入碳酸鈉溶液觀察是否有沉淀生成,判斷鎳離子是否全部沉淀,具體操作步驟為:靜置,在上層清液中繼續滴加1~2滴Na2CO3溶液,無沉淀生成,過濾用到的玻璃儀器有燒杯、漏斗、玻璃棒;
故答案為:靜置,在上層清液中繼續滴加1~2滴Na2CO3溶液,無沉淀生成;漏斗、玻璃棒;
(2)碳酸鎳與稀硫酸反應生成硫酸鎳、二氧化碳、水,反應的離子方程式為NiCO3+2H+=Ni2++H2O+CO2↑,
故答案為:NiCO3+2H+=Ni2++H2O+CO2↑;
(3)由圖可知,隨n值越大,合成氨的相對初始速率越大,而n增大,Co2+的比例增大,故Co2+的催化活性更高,
故答案為:Co2+;
(4)空氣中加熱Ni(OH)2和空氣中氧氣反應生成NiOOH和水,原子守恒配平書寫化學方程式為:4Ni(OH)2+O2$\frac{\underline{\;△\;}}{\;}$4NiOOH+2H2O,
故答案為:4Ni(OH)2+O2$\frac{\underline{\;△\;}}{\;}$4NiOOH+2H2O;
(5)消耗KMnO4物質的量:0.01 mol•L-1×0.01L=1×10-4 mol,根據電子得失守恒可知Ni(OH)2的物質的量為5×10-4mol,則樣品中總Ni(OH)2的物質的量為5×10-4 mol×$\frac{500}{25}$=0.01mol,
n(NiOOH)=$\frac{9.21g-0.01mol×92.7g/mol}{91.7g/mol}$=0.09 mol
x:y=n(NiOOH):n[Ni(OH)2]=0.09 mol:0.01 mol=9:1,
故答案為:9:1.
點評 本題考查了物質分離方法和實驗過程分析判斷,溶度積常數和離子積常數的計算應用,注意流程的理解應用,掌握實驗基礎和物質性質是關鍵,題目難度中等.


 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源: 題型:解答題
 研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.
研究和開發CO2 和CO的創新利用是環境保護和資源利用的雙贏的課題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
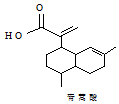
| A. | 青蒿酸的分子式為C15H20O2 | |
| B. | 1mol青蒿酸最多可與3molH2加成 | |
| C. | 青蒿酸與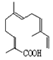 互為同分異構體 互為同分異構體 | |
| D. | 苯環上連有-CHO和-OH、分子中有6種不同化學環境氫的青蒿酸的同分異構體只有2種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a=$\frac{PM}{2000ρ}$ | B. | P=$\frac{200ρa}{M}$ | C. | P$\frac{1000ρ×a%}{M}$×2 | D. | V×ρ×a%=$\frac{PMV}{1000}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨水應密閉保存,放置于低溫處 | |
| B. | 對2HI(g)?H2(g)+I2(g)平衡體系,增大平衡體系的壓強可使氣體顏色變深 | |
| C. | 生產硝酸的過程中使用過量空氣以提高氨氣的利用率 | |
| D. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,當加入AgNO3溶液后,溶液顏色變淺 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com