
| A. | 當體系壓強不變時反應一定達到平衡 | |
| B. | 反應放出的熱量為 0.2a kJ | |
| C. | 若升高溫度,v(正)加快,v(逆)減慢,平衡正向移動 | |
| D. | 在相同條件下再加入0.2mol的CO和0.2mol的 H2O(g),重新達平衡時,c(CO):c(CO2)=3:2 |
分析 A.該反應為反應前后氣體物質的量不變的反應;
B.0.2molCO不能完全反應;
C.升高溫度,正逆反應速率均增大,向吸熱的方向移動;
D.容積為2L的密閉容器內,再加入0.2mol的CO和0.2mol的 H2O(g),壓強增大,平衡不移動.
解答 解:A.該反應為反應前后氣體物質的量不變的反應,則當體系壓強不變時,不能判定平衡,故A錯誤;
B.0.2molCO不能完全反應,則反應放出的熱量小于 0.2a kJ,故B錯誤;
C.升高溫度,正逆反應速率均增大,向吸熱的方向移動,則v(正)、v(逆)均加快,平衡正向移動,故C錯誤;
D.容積為2L的密閉容器內,再加入0.2mol的CO和0.2mol的 H2O(g),壓強增大,平衡不移動,重新達平衡時,c(CO):c(CO2)=3:2,故D正確;
故選D.
點評 本題考查化學平衡移動,為高頻考點,把握平衡的判斷、平衡移動、熱化學方程式的意義為解答的關鍵,側重分析與應用能力的考查,注意選項D為解答的難點,題目難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 加入氯化銨固體 | B. | 適當升高溫度 | C. | 通入氨氣 | D. | 加入少量濃鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
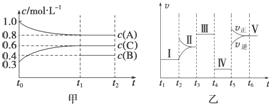 向某密閉容器中加入 4mol A、1.2mol C 和一定量的 B 三種氣體,一定條件 下發生反應,各物質的濃度隨時間變化如甲圖所示[已知 t0~t1 階段保持恒溫、恒容,且 c(B)未畫出].乙圖為 t2 時刻后改變反應條件,反應速率隨時間的變化情況,已知 在 t2、t3、t4、t5 時刻各改變一種不同的條件,其中 t3 時刻為使用催化劑.
向某密閉容器中加入 4mol A、1.2mol C 和一定量的 B 三種氣體,一定條件 下發生反應,各物質的濃度隨時間變化如甲圖所示[已知 t0~t1 階段保持恒溫、恒容,且 c(B)未畫出].乙圖為 t2 時刻后改變反應條件,反應速率隨時間的變化情況,已知 在 t2、t3、t4、t5 時刻各改變一種不同的條件,其中 t3 時刻為使用催化劑.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 工業上生產硝酸的主要過程如下:
工業上生產硝酸的主要過程如下:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 沉淀轉化反應2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常數為20mol•L-1 | |
| B. | 約有2×10-5mol AgCl溶解 | |
| C. | 反應后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c (H+) | |
| D. | 反應后溶液中的:c(Na+)+c (H+)+c (Ag+)=2 c (CO32-)+c (HCO3-)+c (Cl-)+c (OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com