
分析 (1)鐵和氯化鐵反應生成氯化亞鐵,氯化亞鐵溶液中加入鐵粉防止氯化亞鐵被氧化;
(2)氯氣具有氧化性能氧化氯化亞鐵為氯化鐵;
(3)煤油不溶于水,密度比水小,分層后可以隔離溶液與空氣接觸,排除氧氣對實驗的影響;
(4)加入1滴K3[Fe(CN)6]溶液,生成藍色沉淀是亞鐵離子的檢驗特征反應現象,第一支試管中加入1mL CCl4充分振蕩、靜置,CCl4層顯紫色說明生成I2,碘離子被鐵離子氧化為碘單質,隨濃度變小,碘離子在稀的氯化鐵溶液中不發生氧化還原反應;
(5)向盛有H2O2溶液的試管中加入幾滴酸化的FeCl2溶液,溶液變成棕黃色,說明過氧化氫氧化亞鐵離子為鐵離子,鐵離子對過氧化氫分解起到催化劑作用,過氧化氫分解反應放熱,促進Fe3+的水解平衡正向移動.
解答 解:(1)鐵和氯化鐵反應生成氯化亞鐵,在FeCl2溶液中需加入少量鐵屑,其目的是防止氯化亞鐵被氧化,
故答案為:防止氯化亞鐵被氧化;
(2)氯氣具有氧化性能氧化氯化亞鐵為氯化鐵,反應的離子方程式為:Cl2+2Fe2+=2Fe3++2Cl-,
故答案為:Cl2+2Fe2+=2Fe3++2Cl-;
(3)煤油不溶于水,密度比水小,分層后可以隔離溶液與空氣接觸,排除氧氣對實驗的影響,
故答案為:隔離空氣(排除氧氣對實驗的影響);
(4)加入1滴K3[Fe(CN)6]溶液,生成藍色沉淀是亞鐵離子的檢驗特征反應現象,實驗②檢驗的離子是Fe2+,①第一支試管中加入1mL CCl4充分振蕩、靜置,CCl4層顯紫色說明生成I2,碘離子被鐵離子氧化為碘單質,反應的離子方程式為:2I-+2Fe3+=2Fe2++I2,③第三支試管中加入1滴KSCN溶液,溶液變紅,說明隨濃度變小,碘離子在稀的氯化鐵溶液中不發生氧化還原反應,仍含有鐵離子,在I-過量的情況下,溶液中仍含有Fe3+,說明該反應為可逆反應.
故答案為:Fe2+;Fe3+;可逆反應.
(5)向盛有H2O2溶液的試管中加入幾滴酸化的FeCl2溶液,溶液變成棕黃色,說明過氧化氫氧化亞鐵離子為鐵離子,反應的離子方程式為:2Fe2++H2O2+2H+=2Fe3++2H2O,鐵離子對過氧化氫分解起到催化劑作用,產生氣泡的原因是鐵離子做過氧化氫分解催化劑分解生成氧氣,氯化鐵溶液中存在水解平衡,Fe3++3H2O?Fe(OH)3+3H+,水解反應為吸熱反應,過氧化氫分解放出熱量,促進Fe3+的水解平衡正向移動.
故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;鐵離子做過氧化氫分解催化劑分解生成氧氣;過氧化氫分解反應放熱,促進Fe3+的水解平衡正向移動.
點評 本題考查了鐵架化合物性質、主要是溶液配制、離子方程式書寫、離子檢驗、鹽類水解等知識點,注意題干信息的分析判斷,題目難度中等.


 特高級教師點撥系列答案
特高級教師點撥系列答案科目:高中化學 來源: 題型:選擇題
| A. | 2 種 | B. | 4 種 | C. | 8 種 | D. | 16 種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH2O | B. | C2H4O | C. | C2H4O2 | D. | C3H8O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯分子的結構中六個碳原子的連接方式是單雙建交替組成的環狀 | |
| B. | 苯中含有碳碳雙鍵,所以苯屬于烯烴 | |
| C. | 苯分子中6個碳碳化學鍵完全相同 | |
| D. | 苯可以與溴水、高錳酸鉀溶液反應而使它們褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO32- | B. | HCO3- | C. | NO3- | D. | SO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
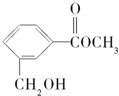
| A. | 有機物M中有2種含氧官能團 | |
| B. | 1mol有機物M可與1mol NaOH發生反應 | |
| C. | 有機物M能與溴水發生加成反應 | |
| D. | 1mol有機物M最多能與3mol H2反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3COOCH2CH2CH3 | B. | CH3CH2COOCH2CH3 | ||
| C. | CH3COOCH2CH3 | D. | CH3CH2COOCH2CH=CH2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com