
| 實驗事實 | 結論 | |
| A | Cl2的水溶液可以導電 | Cl2是電解質 |
| B | SO2通入硝酸鋇溶液出現白色沉淀 | BaSO3不溶于強酸 |
| C | NaHCO3溶液與NaAlO2溶液混合產生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| D | 常溫下白磷可自燃而N2須在放電時才與O2反應 | 非金屬性:P>N |
| A. | A | B. | B | C. | C | D. | D |
分析 A.電解質必須為化合物;
B.SO2通入硝酸鋇溶液,發生氧化還原反應生成硫酸鋇沉淀;
C.NaHCO3溶液與NaAlO2溶液混合,偏鋁酸根離子促進碳酸氫根離子電離;
D.比較非金屬性的角度錯誤.
解答 解:A.電解質必須為化合物,Cl2的水溶液可以導電,但氯氣本身不能電離,且氯氣為單質,則氯氣既不是電解質也不是非電解質,故A錯誤;
B.SO2通入硝酸鋇溶液,發生氧化還原反應生成硫酸鋇沉淀,則BaSO3能溶于強酸,結論不合理,故B錯誤;
C.NaHCO3溶液與NaAlO2溶液混合,偏鋁酸根離子促進碳酸氫根離子電離生成氫氧化鋁沉淀,則酸性:HCO3->Al(OH)3,故C正確;
D.應用氫化物的穩定性或最高價氧化物的水化物的酸性比較,比較非金屬性的角度錯誤,故D錯誤;
故選C.
點評 本題考查化學實驗方案的評價,為高頻考點,涉及氧化還原反應、電離及電解質的判斷等,把握物質的性質及化學反應原理等為解答的關鍵,注意實驗的評價性分析,題目難度不大.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
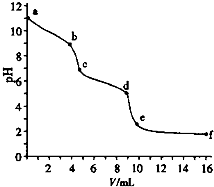 用已知濃度的鹽酸滴定未知濃度的Na2CO3溶液.用 pH傳感器測得混合溶液的pH變化曲線如圖(已知:飽和CO2溶液pH為5.6),下列說法正確的是( )
用已知濃度的鹽酸滴定未知濃度的Na2CO3溶液.用 pH傳感器測得混合溶液的pH變化曲線如圖(已知:飽和CO2溶液pH為5.6),下列說法正確的是( )| A. | a處發生的離子反應:CO32-+H2O=HCO3-+OH- | |
| B. | 在pH=6時,c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | 在pH=7時,c(Na+)=c(Cl-) | |
| D. | c→d發生的主要離子反應:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定溫度和壓強下,各種氣態物質體積的大小,由構成氣體的分子大小決定. | |
| B. | 氣體摩爾體積是指1摩爾任何氣體所占的體積約為22.4L. | |
| C. | 不同的氣體,若體積不同,則它們所含的分子數也不同 | |
| D. | 一定溫度和壓強下,各種氣態物質體積的大小,由構成氣體的分子數決定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 催化劑組分質量分數(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 達到平衡所需要時間(h) | 2.5 | 7.4 | 8.1 | 12 | 無催化劑 | |



查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 它既不溶于水,也不溶于NaHCO3溶液.能夠跟1mol該化合物起反應的H2或HBr的最大用量分別是( )
它既不溶于水,也不溶于NaHCO3溶液.能夠跟1mol該化合物起反應的H2或HBr的最大用量分別是( )| A. | 1mol﹑2mol | B. | 4mol﹑4mol | C. | 4mol﹑2mol | D. | 4mol﹑1mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀鹽酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 濃硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com