
| 實驗序號 | 滴定管液面起始讀數 | 滴定管液面終點讀數 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
分析 (1)依據C=$\frac{1000ρω}{M}$計算濃鹽酸的物質的量濃度,然后依據稀釋前后溶質的物質的量不變計算所需濃鹽酸的體積,據此選擇合適的量筒;
配制0.200mol•L-1的鹽酸溶液500mL應選擇500ml容量瓶;
依據配制一定物質的量濃度溶液的一般步驟排序;
(2)先判斷數據的合理性,然后NaOH溶液的平均體積,然后根據HCl~NaOH求氫氧化鈉的物質的量濃度;
(3)依據中和滴定正確操作解答;
(4)根據c(待測)=$\frac{C(標準)×V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差.
解答 解:(1)濃鹽酸的物質的量濃度=$\frac{1000×36.5%×1.20}{36.5}$=12.0mol/L,設需要濃鹽酸的體積為:V,則0.200mol•L-1×500ml=12.0mol/L×V,解得V=
8.3ml,所以應選擇10ml量筒;
配制0.200mol•L-1的鹽酸溶液500mL應選擇500ml容量瓶,將溶液轉移到500ml容量瓶中配置;
配制一定物質的量濃度溶液的一般步驟為:計算、量取、稀釋、移液、洗滌、定容、搖勻、裝瓶,所以正確的順序為:A B D E C F;
故答案為:b; 8.3mL; 500mL容量瓶;A B D E C F;
(2)兩次消耗的NaOH溶液的體積為22.04mL,21.96mL,均有效,鹽酸溶液的平均體積為22.00mL,
HCl~NaOH
1 1
0.200mol•L-1×22.00mL c(NaOH)×20.00mL
解得:c(NaOH)=0.22mol/L;
故答案為:0.22 mol/L;
(3)A.滴定過程中,眼睛注視錐形瓶顏色變化,故錯誤;
B.滴定過程中由于搖動錐形瓶使少許溶液濺起沾在瓶內壁,為使測定結果正確,可用少許蒸餾水將其沖入錐形瓶內的溶液中,保證錐形瓶中所含溶質全部反應,故正確;
C.容量瓶和滴定管都帶有塞子,為防止漏液,試用前需要檢查是否漏水,故正確;
D.向錐形瓶中移取NaOH溶液前,用少許NaOH溶液潤洗錐形瓶2~3次,導致待測液體積增大,則加入的標準液偏多,溶液濃度偏大,故錯誤;
故選:BC;
(4)A.滴定過程中不小心將一滴溶液滴在錐形瓶外,導致消耗的標準液偏多,結果偏大;
B.滴定結束時,發現在滴定管尖嘴處有小氣泡,導致所加的標準液偏小,結果偏小;
C.滴定結束后仰視滴定管液面讀數,導致消耗的標準液的體積偏大,結果偏大;
D.溶液褪色立即讀數,搖動錐形瓶后看到溶液紅色復出,過早判斷滴定終點,導致所加標準液偏小,結果偏小;
E.酸式滴定管用蒸餾水洗凈后,未用標準鹽酸潤洗,直接加入標準液進行滴定,導致所加的標準液偏大,結果偏大;
故選:ACE.
點評 本題考查了一定物質的量濃度溶液的配置和酸堿的中和滴定,熟悉配制一定物質的量濃度溶液原理和步驟,熟悉中和滴定的原理是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 銅片、鐵片、FeCl3溶液組成的原電池 | |
| B. | 石墨、鐵片、Fe(NO3)3溶液組成的原電池 | |
| C. | 銀片、鐵片、Fe(NO3)2溶液組成的原電池 | |
| D. | 鐵片、銅片、Fe2(SO4)3溶液組成的原電池 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
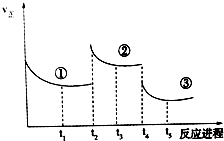 已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密閉容器中加入2mol SO2和1mol O2,一定條件下反應達到平衡,在t2和t4時刻分別只改變一個條件(溫度或壓強),反應過程中正反應速率如圖所示,下列說法正確的是 ( )
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密閉容器中加入2mol SO2和1mol O2,一定條件下反應達到平衡,在t2和t4時刻分別只改變一個條件(溫度或壓強),反應過程中正反應速率如圖所示,下列說法正確的是 ( )| A. | t2~t3時間段,平衡向逆反應方向移動 | |
| B. | t4時刻改變的條件是減小壓強 | |
| C. | 平衡狀態①和②,SO2轉化率相同 | |
| D. | 平衡狀態①和②,平衡常數K值相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 藍礬 玻璃 無色的剛玉 | B. | 汽油 液氯 醋酸 | ||
| C. | 石蠟 純鹽酸 王水 | D. | 干冰 鋁熱劑 鐵觸媒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH、CuSO4、HCl、KNO3 | B. | HCl、KOH、NaCl、Na2SO4 | ||
| C. | Ca(OH)2、Na2CO3、NaCl、HCl | D. | NaNO3、MgCl2、KCl、Ba(OH)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2、CH4都屬于極性鍵的非極性分子 | |
| B. | C、N、O、F 電負性依次減小 | |
| C. | 基態銅(Cu)原子的電子排布式為[Ar]3d94s2 | |
| D. | 價電子構型為3s23p4的粒子其電子排布圖為: |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
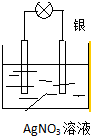 利用化學反應將存儲在物質內部的化學能轉化為電能,科學家設計出了原電池,從而為人類生產、生活提供能量.
利用化學反應將存儲在物質內部的化學能轉化為電能,科學家設計出了原電池,從而為人類生產、生活提供能量.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1160 | B. | 2308 | C. | 1441 | D. | 2320 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com