
【題目】(1)同溫同壓下,同體積的甲烷(CH4)和二氧化碳原子總數之比為_____,密度之比為_____。
(2)在標準狀況下,CO和CO2的混合氣體共39.2L,質量為61g,則其中CO2為____ mol。
(3)9.03×1023個NH3含___mol氫原子,在標準狀況下的體積為____L。
【答案】5:3 4:11 0.75 4.5 33.6
【解析】
(1)同溫同壓下,氣體的體積之比等于物質的量之比,因此同體積的甲烷和二氧化碳物質的量之比為1:1,分子數目之比為1:1,1個CH4分子中含有5個原子,1個二氧化碳分子中含有3個原子,分子數目相同,則原子數目之比為5:3,密度之比等于摩爾質量之比,即為16:44=4:11;
(2)在標準狀況下,CO和CO2的混合氣體共39.2L,則兩種氣體的物質的量之和為![]() ,設CO2物質的量為x mol,則CO物質的量為(1.75-x)mol,混合氣體的質量為61g,可列式:
,設CO2物質的量為x mol,則CO物質的量為(1.75-x)mol,混合氣體的質量為61g,可列式:![]() ,解得x=0.75mol,即CO2物質的量為0.75mol;
,解得x=0.75mol,即CO2物質的量為0.75mol;
(3)1mo任何物質中含有6.02×1023個分,則9.03×1023個氨(NH3)分子含氨分子的物質的量為![]() =1.5mol,1個氨分子中含有3個氫原子,則9.03×1023個氨(NH3)分子含1.5mol×3=4.5mol氫原子;標準狀況下,氨氣所占的體積為1.5mol×22.4L/mol=33.6L。
=1.5mol,1個氨分子中含有3個氫原子,則9.03×1023個氨(NH3)分子含1.5mol×3=4.5mol氫原子;標準狀況下,氨氣所占的體積為1.5mol×22.4L/mol=33.6L。


 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:
【題目】在電鍍車間的含鉻酸性廢水中,鉻的存在形式有Cr(Ⅵ)和Cr(Ⅲ)兩種,其中以Cr(Ⅵ)的毒性最大。電解法處理含鉻廢水如圖,鉻最終以Cr(OH)3沉淀除去。下列說法正確的是
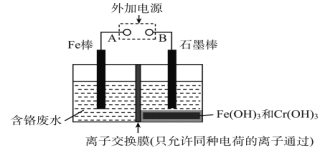
A. Fe為陽極,反應為Fe-2e-=Fe2+
B. 陰極反應為Cr2O72-+7H2O+6e-=2Cr(OH)3↓+8OH-
C. 陽極每轉移3mol電子,可處理Cr(Ⅵ)物質的量為1mol
D. 離子交換膜為質子交換膜,只允許H+穿過
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以Na2SO3溶液和不同金屬的硫酸鹽溶液作為實驗對象,探究鹽的性質和鹽溶液間反應的多樣性。
實驗 | 試劑 | 現象 | |
滴管 | 試管 | ||
| 0.2 mol·L1Na2SO3溶液 | 飽和Ag2SO4溶液 | Ⅰ.產生白色沉淀 |
0.2 mol·L1CuSO4 | Ⅱ.溶液變綠,繼續滴加產生棕黃色沉淀 | ||
0.1 mol·L1Al2(SO4)3溶液 | Ⅲ.開始無明顯變化,繼續滴加產生白色沉淀 | ||
(1)經檢驗,現象Ⅰ中的白色沉淀是Ag2SO3。用離子方程式解釋現象Ⅰ:____________。
(2)經檢驗,現象Ⅱ的棕黃色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸證實沉淀中含有Cu+的實驗現象是_____________。
②通過下列實驗證實,沉淀中含有Cu2+和SO32。

a.白色沉淀A是BaSO4,試劑1是____________。
b.證實沉淀中含有Cu+和SO32的理由是___________。
(3)已知:Al2(SO3)3在水溶液中不存在。經檢驗,現象Ⅲ的白色沉淀中無SO42,該白色沉淀既能溶于強酸,又能溶于強堿,還可使酸性KMnO4溶液褪色。
①推測沉淀中含有亞硫酸根和________。
②對于沉淀中亞硫酸根的存在形式提出兩種假設:i.唄Al(OH)3所吸附;ii.存在于鋁的堿式鹽中。對假設ii設計了對比實驗,證實了假設ii成立。
a.將對比實驗方案補充完整。

步驟二:_____________(按上圖形式呈現)。
(4)根據實驗,亞硫酸鹽的性質有___________。鹽溶液間反應的多樣性與__________有關。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某燒堿樣品中含有少量不與酸作用的可溶性雜質,為了測定其純度,進行以下滴定操作:
A.用250mL容量瓶等儀器配制成250mL燒堿溶液;
B.用移液管(或堿式滴定管)量取25mL燒堿溶液于錐形瓶中并加幾滴甲基橙指示劑;
C.在天平上準確稱取燒堿樣品W g,在燒杯中加蒸餾水溶解;
D.將物質的量濃度為M molL﹣1的標準HCl溶液裝入酸式滴定管,調整液面,記下開始刻度數V1 mL;
E.在錐形瓶下墊一張白紙,滴定到終點,記錄終點耗酸體積V2 mL。
回答下列問題:
(1)正確的操作步驟是(填寫字母)________→________→________→D→________;
(2)滴定時,左手握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視________________;
(3)終點時顏色變化是_____________________;
(4)在上述實驗中,下列操作(其他操作正確)會造成測定結果偏高的有_____(填字母序號);
A.滴定終點讀數時俯視 B.錐形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用鹽酸潤洗 D.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
(5)該燒堿樣品的純度計算式是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置,密閉容器內分別充入空氣和H2、O2的混合氣體在可移動的活塞兩邊,在標準狀況下若將H2、O2的混合氣體點燃引爆,活塞先左彈,恢復原溫度后,活塞右滑停留于容器的中央,則原來H2、O2的體積比可能為

A. 7∶2
B. 5∶4
C. 3∶5
D. 2∶7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表是一座開放的“元素大廈”,”元素大廈”尚未客滿。若發現120號元素,請在“元素大廈”中安排好它的“房間”
A.第七周期0族B.第七周期第IIA族C.第八周期第IIA族D.第八周期第IA族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是

A. 通電后中間隔室的SO42-離子向正極遷移,正極區溶液pH增大
B. 該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
C. 負極反應為2H2O–4e–=O2+4H+,負極區溶液pH降低
D. 當電路中通過1mol電子的電量時,會有0.5mol的O2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素W、X、Y、Z的原子序數依次增加。m、p、r是由這些元素組成的二元化合物,n是元素Z的單質,通常為黃綠色氣體,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH為2,s通常是難溶于水的混合物。上述物質的轉化關系如圖所示。下列說法正確的是( )

A. 原子半徑的大小W <X<Y B. 元素的非金屬性Z>X>Y
C. Y的氫化物常溫常壓下為液態 D. X的最高價氧化物的水化物為強酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向1.0 L密閉容器中加入0.60 mol X(g),發生反應X(g)![]() Y(s)+2Z(g) ΔH>0,測得反應物X的濃度與反應時間的數據如下表:
Y(s)+2Z(g) ΔH>0,測得反應物X的濃度與反應時間的數據如下表:

(1)0~3 min用Z表示的平均反應速率v(Z)=____。
(2)分析該反應中反應物的濃度與時間的規律,得出的結論是_____________。由此規律推出反應在6 min時反應物的濃度a為____mol·L-1。
(3)反應的逆反應速率隨時間變化的關系如圖所示,t2時改變的條件可是______、_____。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com