
【題目】
三位分別來自瑞士、美國、英國的科學家因發展“冷凍電子顯微鏡技術對溶液中的生物分子進行高分辨率結構測定”所做出的貢獻而獲得2017年諾貝爾化學獎。含有有機雜化鋅、鍺以及砷等金屬的硒化物具有離子交換、催化、吸附、半導體等性能,顯示出良好的應用前景。回答下列問題:
(1)鋅基態原子核外電子排布式為_________。位于元素周期表五個分區中的________區。
(2)元素鍺與砷中,第一電離能較大的是________ (填元素符號,下同),基態原子核外未成對電子數較少的是________。
(3)元素砷與氮同主族,二者的氫化物中熔沸點較高的是_________,原因是________。
(4)H2SeO3分子中Se 原子的雜化形式為________,H2SeO4的酸性比H2SeO3強,原因是________ 。
(5)氣態SeO3分子的立體構型為______,與SeO3互為等電子體的一種離子為_____(填離子符號)。
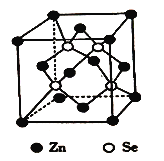
(6)硒化鋅是一種重要的半導體材料,其晶胞結構如圖所示,該晶胞中硒原子的配位數為_____,若該晶胞密度為ρg/cm3,硒化鋅的摩爾質量為Mg/mol。用NA代表阿伏伽德羅常數的數值,則晶胞參數α為_____nm。
【答案】 {[Ar]3d104s2} ds As Ge NH3 NH3分子間存在氫鍵 sp3 H2SeO4分子中非羥基的氧原子數大了H2SeO3 平面三角形 CO32- 4 ![]()
【解析】(1)鋅是30號元素,其原子核外有30個電子,根據構造原理知其基態原子核外電子排布式為:1s22s22p63s23p63d104s2或[Ar]3d104s2;位于元素周期表五個分區中的ds區;(2)同一周期中,元素的第一電離能隨著原子序數增大而呈增大趨勢,但第ⅤA族元素第一電離能大于相鄰元素,所以元素鍺與砷中,第一電離能較大的是As;元素鍺與砷中,基態原子核外未成對電子數分別為2和3,較少的是Ge;(3) 元素砷與氮同主族,NH3分子間存在氫鍵,熔沸點較高;(4)H2SeO3分子中Se原子在S8分子中S原子成鍵電子對數為4,孤電子對數為1,即價層電子對數為4,所以其雜化軌道類型為sp3;H2SeO3的分子結構為![]() ,Se為+4價,而H2SeO4的分子結構為
,Se為+4價,而H2SeO4的分子結構為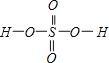 ,Se為+6價,H2SeO4分子中非羥基的氧原子數大于H2SeO3,后者Se原子吸電子能力強,則羥基上氫原子更容易電離出H+;(5)根據價層電子對互斥理論可知,SeO3分子中中心原子含有的孤對電子對數=6-3×226-3×22=0,即氣態SeO3分子中Se形成3個δ鍵,沒有孤電子對,所以該分子形成的空間構型是平面三角形;SeO3是24e-,24e-等電子體有:NO3-、CO32-等;(6)根據硒化鋅晶胞結構圖可知,每個鋅原子周圍有4個硒原子,每個硒原子周圍也有4個鋅原子,所以硒原子的配位數為4,該晶胞中含有硒原子個數為8
,Se為+6價,H2SeO4分子中非羥基的氧原子數大于H2SeO3,后者Se原子吸電子能力強,則羥基上氫原子更容易電離出H+;(5)根據價層電子對互斥理論可知,SeO3分子中中心原子含有的孤對電子對數=6-3×226-3×22=0,即氣態SeO3分子中Se形成3個δ鍵,沒有孤電子對,所以該分子形成的空間構型是平面三角形;SeO3是24e-,24e-等電子體有:NO3-、CO32-等;(6)根據硒化鋅晶胞結構圖可知,每個鋅原子周圍有4個硒原子,每個硒原子周圍也有4個鋅原子,所以硒原子的配位數為4,該晶胞中含有硒原子個數為8![]() +6×
+6×![]() =4,根據
=4,根據![]() =
=![]() =
=![]() ,所以V=
,所以V=![]() ,則晶胞的邊長為:
,則晶胞的邊長為: 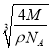 cm=
cm=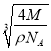 ×107nm。
×107nm。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】科學家正在研究溫室氣體CH4和CO2的轉化和利用。請回答下列問題:
(1)處于一定空間運動狀態的電子在原子核外出現的概率密度分布可用____________形象化描述。在基態14C原子中,核外存在___________對自旋相反的電子。
(2)CH4和CO2所含的三種元素電負性從小到大的順序為__________________________。
(3)一定條件下,CH4和CO2都能與H2O形成籠狀結構(如下圖所示)的水合物晶體,其相關參數見下表。CH4與H2O形成的水合物俗稱“可燃冰”。
參數 分子 | 分子直徑/nm | 分子與H2O的結合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
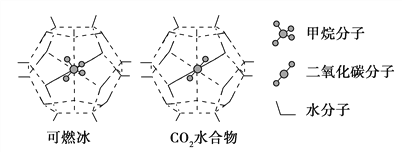
①下列關于CH4和CO2的說法正確的是________(填序號)。
a.CO2分子中含有2個σ鍵和2個π鍵
b.CH4分子中含有極性共價鍵,是極性分子
c.因為碳氫鍵鍵能小于碳氧鍵,所以CH4熔點低于CO2
d.CH4和CO2分子中碳原子的雜化類型分別是sp3和sp
②為開采深海海底的“可燃冰”,有科學家提出用CO2置換CH4的設想。已知上圖中籠狀結構的空腔直徑為0. 586 nm,根據上述圖表所提供的數據分析,提出該設想的依據是______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、甲醇既是重要的化工原料,又可作為燃料,利用CO和H2在催化劑作用下可合成甲醇(g)。
(1)已知相關的化學鍵鍵能數據如下:
化學鍵 | H—H | C—O | C≡O | H—O | C—H |
E(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
合成甲醇(g)的熱化學方程式為______________________________________________。
(2)500K、101KPa條件下,反應過程中測得n(CO)、n(H2)、n(CH3OH)隨時間t變化的關系如圖甲所示。現保持其它條件不變,起始只改變溫度,在改變的這個溫度下反應至t1時刻,此時n(H2)比圖象中的值大,那么該溫度可能是________。
A、700K B、373K C、以上均不對
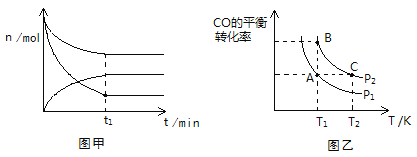
(3)在一容積可變的密閉容器中充入1 mol CO和2 mol H2,發生反應并達到平衡,CO的平衡轉化率隨溫度(T)和壓強(P)的變化曲線如圖乙所示。P1、P2的大小關系為________;A、B、C三點的平衡常數(K)大小關系為______________________。
Ⅱ、可逆反應:①X(g)+2Y(g)![]() 2Z(g);②2M(g)
2Z(g);②2M(g)![]() N(g)+P(g),分別在密閉容器的兩個反應室中進行,反應室之間放有無摩擦、可滑動的密封隔板。反應開始和達到平衡狀態時有關物理量的變化如圖所示:
N(g)+P(g),分別在密閉容器的兩個反應室中進行,反應室之間放有無摩擦、可滑動的密封隔板。反應開始和達到平衡狀態時有關物理量的變化如圖所示:
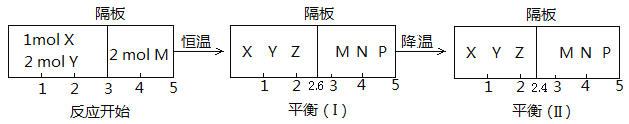
(4)反應①的正反應ΔH______0(填“>”或“<”)。
(5)反應開始時體系的壓強與達平衡(Ⅰ)時體系的壓強之比為_________(用分數表示)。
(6)在平衡(Ⅰ)和平衡(Ⅱ)中,M的體積分數(Ⅰ)______(Ⅱ)。
A、大于 B、小于 C、等于 D、無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列鑒別物質的方法能達到目的的是
A. 用氨水鑒別MgCl2溶液和A1C13溶液
B. 用澄淸石灰水鑒別Na2CO3溶液和NaHCO3溶液
C. 用CaCl2溶液鑒別Na2CO3溶液和NaHCO3溶液
D. 用淀粉溶液鑒別加碘鹽和未加碘鹽
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某純堿樣品中含有少量氯化鈉雜質,現用如圖所示裝置來測定純堿樣品中碳酸鈉的質量分數(鐵架臺、鐵夾等在圖中均已略去).實驗步驟如下:
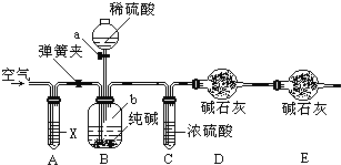
①按圖連接裝置,并檢查氣密性;
②準確稱得盛有堿石灰(固體氫氧化鈉和生石灰的混合物)的干燥管D的質量為85.4g;
③準確稱得6g純堿樣品放入容器b中;
④打開分液漏斗a的旋塞,緩緩滴入稀硫酸,至不再產生氣泡為止;
⑤打開彈簧夾,往試管A中緩緩鼓入空氣數分鐘,然后稱得干燥管D的總質量為87.6g.試回答:
(1)鼓入空氣的目的是___________,裝置A中試劑X應選用___________;
(2)若沒有C裝置,則會導致測定結果___________(填“偏大”或“偏小”);
(3)裝置B中發生反應的離子方程式______________________________;
(4)根據實驗中測得的有關數據,計算出純堿樣品Na2CO3的質量分數為_________(計算結果保留一位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國第二化工設計院提出,用間接電化學法對大氣污染物NO進行無害化處理,其原理示意如圖(質子膜允許H+和H2O通過),下列相關判斷正確的是
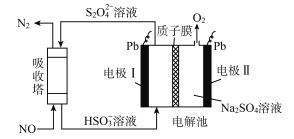
A. 電極I為陰極,電極反應式為2H2O+2e-=2OH-+H2
B. 電解池中質子從電極I向電極Ⅱ作定向移動
C. 吸收塔中的反應為2NO+2S2O32-+H2O=N2+4HSO3-
D. 每處理1 mol NO電解池質量減少16g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】配合物Na2[Fe(CN)5(NO)]可用于離子檢驗,下列說法不正確的是
A. 此配合物中存在離子鍵、配位鍵、極性鍵、非極性鍵
B. 配離子為[Fe(CN)5(NO)]2-,中心離子為Fe3+,配位數為6,配位原子有C和N
C. 1mol配合物中σ鍵數目為12NA
D. 該配合物為離子化合物,易電離,1mol配合物電離共得到3NA陰陽離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列分離或提純物質的方法正確的是( )
A. 用蒸餾的方法制取蒸餾水
B. 用過濾的方法除去NaCl溶液中含有的少量KCl
C. 用溶解、過濾的方法提純含有少量BaSO4的BaCO3
D. 用加熱、蒸發的方法可以除去CaCl2、MgCl2等雜質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】檢驗氯化氫氣體中是否混有氯氣,可采用的方法是( )
A.用干燥的藍色石蕊試紙B.用干燥有色布條
C.將氣體通入硝酸銀溶液D.用濕潤的淀粉碘化鉀試紙
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com