
【題目】反應C(s)+CO2(g)![]() 2CO(g)在恒容容器、一定溫度下達到平衡,再充入CO2,達到新的平衡時(溫度不變),與原平衡比,以下正確的是
2CO(g)在恒容容器、一定溫度下達到平衡,再充入CO2,達到新的平衡時(溫度不變),與原平衡比,以下正確的是
A.平衡向正反應方向移動B.混合氣體的平均摩爾質量增大
C.CO2的轉化率增大D.正反應速率增大逆反應速率減小
【答案】B
【解析】
對于反應C(s)+CO2(g)![]() 2CO(g)的平衡體系,若保持壓強不變通入CO2,達到新的平衡與原平衡為等效平衡,但該題中為恒容容器,相當于在等效平衡的基礎上壓縮容器體積,增大壓強,平衡會逆向移動,所以該題中新的平衡狀態中CO2的體積分數增大,轉化率減小。
2CO(g)的平衡體系,若保持壓強不變通入CO2,達到新的平衡與原平衡為等效平衡,但該題中為恒容容器,相當于在等效平衡的基礎上壓縮容器體積,增大壓強,平衡會逆向移動,所以該題中新的平衡狀態中CO2的體積分數增大,轉化率減小。
A.根據分析可知新的平衡狀態中CO2的體積分數增大,轉化率減小,相當于平衡逆向移動,A錯誤;
B.混合體系中CO2的體積分數越大平均摩爾質量越大,B正確;
C.根據分析可知CO2的轉化率減小,C錯誤;
D.通入CO2后達到新的平衡之前反應正向移動,CO物質的量增大,所以體系中CO2和CO的濃度均增大,正逆反應速率均增大, D錯誤。
答案為B。


科目:高中化學 來源: 題型:
【題目】下列設計的實驗方案能達到相應實驗目的的是( )
選項 | 實驗目的 | 實驗方案 |
A | 探究化學反應的限度 | 取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反應,可根據溶液中既含I2又含I-的實驗事實判斷該反應是可逆反應 |
B | 探究濃度對化學反應速率的影響 | 用兩支試管各取5mL0.1mol/L的KMnO4溶液,分別加入2mL0.1mol/L和0.2mol/L的H2C2O4(草酸)溶液,記錄溶液褪色所需的時間 |
C | 驗證醋酸鈉溶液中存在水解平衡 | 取CH3COONa溶液于試管中并加入幾滴酚酞試劑,再加入醋酸銨固體其水溶液呈中性,觀察溶液顏色變化 |
D | 證明溴乙烷的消去反應有乙烯生成 | 將NaOH的乙醇溶液加入溴乙烷中加熱,將產生的氣體直接通入酸性KMnO4溶液中 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)按系統命名法命名。
①CH3CH(C2H5)CH(CH3)2:_______________________________。
②CH3CH(CH2CH3)CH(CH2CH3)CH2CH(CH3)2:____________________。
③CH3CH(CH3)CH(CH2CH3)C(CH3)3:__________________________________。
(2)寫出下列各種有機物的結構簡式:
①2,3-二甲基-4-乙基己烷:________________________________。
②支鏈只有一個乙基且相對分子質量最小的烷烴:________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)化合物![]() 的相對分子質量為86,所含碳的質量分數為
的相對分子質量為86,所含碳的質量分數為![]() ,氫的質量分數為
,氫的質量分數為![]() ,其余為氧。
,其余為氧。
①![]() 的分子式為______。
的分子式為______。
②![]() 有多種同分異構體,寫出五個同時滿足下列條件的同分異構體的結構簡式:______、______、______、______、______。
有多種同分異構體,寫出五個同時滿足下列條件的同分異構體的結構簡式:______、______、______、______、______。
(i)含有酯基(ii)能使溴的四氯化碳溶液褪色
(2)烴基烯基醚(![]() )
)![]() 的相對分子質量為176,其分子中碳氫原子個數比為
的相對分子質量為176,其分子中碳氫原子個數比為![]() ,則
,則![]() 的分子式為______。
的分子式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列各組有機物:
①![]() 和
和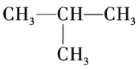
②![]() 和
和![]()
③![]() 和
和![]()
④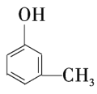 和
和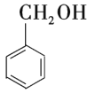
⑤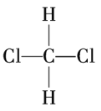 和
和
⑥![]() 和
和![]() (環戊烷)
(環戊烷)
⑦![]() 和
和![]()
(1)其中互為同分異構體的是______(填序號,下同);
(2)其中屬于碳鏈異構的是______;
(3)其中屬于位置異構的是______;
(4)其中屬于官能團異構的是__________。
(5)其中屬于同一種物質的是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下是處于研究階段的“人工固氮”的新方法。N2在催化劑表面與水發生反應:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)-1530.4kJ,完成下列填空:
4NH3(g)+3O2(g)-1530.4kJ,完成下列填空:
(1)該熱化學反應方程式的意義是________________________________________。
(2)上述反應達到平衡后,保持其他條件不變,升高溫度,重新達到平衡時_______。
a.平衡常數K增大 b.H2O的濃度減小
c.容器內的壓強增大 d.v逆(O2)減小
(3)部分實驗數據見下表(條件:2L容器、催化劑、光、N21mol、水3mol、反應時間3 h):
序號 | 第一組 | 第二組 | 第三組 | 第四組 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四組容器中3小時內以NH3表示的平均反應速率是________________。第四組容器內NH3生成量最小的可能原因是_________________________________________。
(4)若用該反應進行工業生產,請選擇適宜的條件___________________________ 。
(5)氨氣大量用于制尿素,銨態氮肥以及硝酸,氨還可用做致冷劑。在(NH4)2SO4溶液中存在水解反應,常溫下該水解反應的平衡常數表達式可表示為K=_____________。
(6)有等濃度的下列三種溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4,c(NH4+)由大到小的順序是____________________;若換成pH值相等,則三種溶液中,c(NH4+)由大到小的順序是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PCl3和PCl5能發生如下水解反應:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl,現將一定量的PCl3和PCl5混合物溶于足量水中,在加熱條件下緩緩通入0.020molO2,恰好將H3PO3氧化為H3PO4。往反應后的溶液中加入15.725gCa(OH)2,充分反應后磷元素全部轉化為Ca3(PO4)2沉淀,過濾后得到2.5L濾液,測得pH為12。計算:
(1)Ca3(PO4)2(已知式量310)沉淀的質量____________;
(2)濾液中溶質的物質的量濃度__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溶液中除鐵時還常用NaClO3作氧化劑,在較小的pH條件下最終生成一種淺黃色的黃鐵礬鈉 [Na2Fe6(SO4)4(OH)12]沉淀除去。下圖是溫度-pH與生成的沉淀關系圖,圖中陰影部分是黃鐵礬穩定存在的區域。下列說法不正確的是 {已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
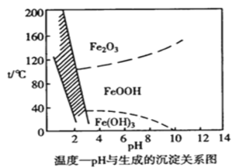
A.工業生產黃鐵礬鈉,溫度控制在85~95℃pH=1.5左右
B.pH=6,溫度從80℃升高至150℃體系得到的沉淀被氧化
C.用氯酸鈉在酸性條件下氧化Fe2+ 離子方程式為:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
D.在25℃時溶液經氧化,調節溶液pH=4 ,此時溶液中c(Fe3+)=2.64×10-9 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘酸鉀作為食鹽—碘添加劑,而碘化鉀則是化工生產中一種重要原料。還原法生產碘化鉀是由碘與氫氧化鉀反應生成碘酸鉀后,用甲酸還原而得,其主要流程如圖。
請回答下列問題:
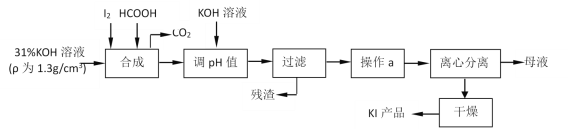
(1)判斷“合成”過程中,碘是否已完全反應的方法是___。
(2)實驗室中,過濾操作要求“一貼二低三靠”,其中“三靠”是指盛有被過濾液體的燒杯注液口緊靠玻璃棒、___、___。
操作a包括“蒸發濃縮、冷卻結晶”是依據KI具有何種性質:___。
(3)寫出“合成”過程中,HCOOH參與的離子反應方程式:___。
(4)測定產品中KI含量的方法是:
a.稱取3.340g樣品、溶解,在250mL容量瓶中定容;
b.量取25.00mL溶液于錐形瓶中,加入足量KIO3,用少量稀硫酸酸化所,使KIO3與KI反應完全;
c.以淀粉為指示劑,用0.2400mol/L的Na2S2O3溶液滴定,消耗溶液體積平均值為10.00mL。
已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-。
①測定過程所需儀器在使用前必須檢查是否漏液的有___。
②該樣品中KI的質量分數為___。(保留3位有效數字)
(5)有學生選用家庭廚房中的有關調料(如黃酒、白醋、醬油、味精等),用簡便方法來檢測是否是加碘食鹽。通過實踐,發現廠商只要在食鹽包裝的封口處夾一條碘化鉀淀粉試紙,并在袋上注明使用方法就能鑒別真偽。現請你寫出檢測使用說明書___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com