
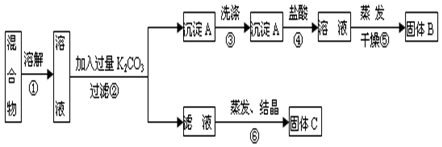
分析 分離KCl和BaCl2兩種固體混合物,可先溶于水,然后加入過量K2CO3使BaCl2轉化為A碳酸鋇沉淀,過濾后沉淀加入鹽酸可生成BaCl2溶液,經⑤蒸發、結晶后可得B固體BaCl2,操作②所得濾液為KCl和K2CO3的混合物,應加入過量鹽酸可得KCl,固體C為KCl,以此解答該題,以此解答該題.
解答 解:分離KCl和BaCl2兩種固體混合物,可先溶于水,然后加入過量K2CO3使BaCl2轉化為A碳酸鋇沉淀,過濾后沉淀加入鹽酸可生成BaCl2溶液,經⑤蒸發、結晶后可得B固體BaCl2,操作②所得濾液為KCl和K2CO3的混合物,應加入過量鹽酸可得KCl,固體C為KCl;
(1)氯化鉀和氯化鋇溶液中加入碳酸鉀溶液可以生成碳酸鋇沉淀,則沉淀A為BaCO3;過濾后碳酸鋇沉淀中加入鹽酸可生成BaCl2溶液,經⑤蒸發、結晶后可得B固體BaCl2,故答案為:BaCl2;
(2)蒸發時,蒸發皿可以放在鐵圈上或泥三角上直接用酒精燈加熱,蒸發皿耐高溫,不用墊石棉網.
故答案為:AD;
(3)蒸發結晶前應加入適量稀鹽酸,將過量的碳酸鉀轉化成氯化鉀,否則晶體不純,
故答案為:應先在⑥步操作前的濾液中加足量鹽酸后,蒸發結晶;
(4)固體溶解后加入過量K2CO3使BaCl2轉化為碳酸鋇沉淀,過濾后沉淀加入試劑b鹽酸可將碳酸鋇轉化成BaCl2溶液,然后經蒸發、結晶、干燥后可得固體BaCl2,若要測定原混合物中KCl和BaCl2的質量分數,除了要準確稱量混合物的質量外,至少還要獲得的數據是固體B或沉淀A’的質量,依據B為BaCl2計算得到質量分數,A'為碳酸鋇,結合鋇元素守恒計算氯化鋇質量得到,
故答案為:固體B或沉淀A的質量;
(5)②加入碳酸鉀生成碳酸鋇沉淀,反應的離子方程式為Ba2++CO32-═BaCO3↓,④為碳酸鋇和鹽酸的反應,離子方程式為BaCO3+2H+═Ba2++CO2↑+H2O,
故答案為:Ba2++CO32-═BaCO3↓;BaCO3+2H+═Ba2++CO2↑+H2O.
點評 本題考查混合物分離提純實驗,把握流程中的化學反應及混合物分離方法為解答的關鍵,注意把握物質的性質,根據性質選擇反應試劑,把握化學基本實驗操作方法的知識,側重分析與實驗能力的考查,題目難度不大.


科目:高中化學 來源:2016-2017學年甘肅省高二上10月月考化學試卷(解析版) 題型:選擇題
下列化合物屬于弱電解質的是( )
A.HCl B.Ba(OH)2 C.CO2 D.NH3·H2O
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.5mol/L | B. | 2.0mol/L | C. | 1mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | HClO═H++ClO- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 此反應在任何溫度下都能自發進行 | |
| B. | 此反應僅在低溫下自發進行 | |
| C. | 此反應僅在高溫下自發進行 | |
| D. | 此反應在任何溫度下都不能自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | CO2的比例模型: | |
| B. | 甲烷的電子式 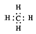 | |
| C. | 硫離子的核外電子排布式 1s22s22p63s23p4 | |
| D. | 碳-12原子構成${\;}_6^{12}$C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸鈣和鹽酸反應 CO32-+2H+=H2O+CO2↑ | |
| B. | 向氫氧化鋇溶液中加硫酸溶液 Ba2++SO42-=BaSO4↓ | |
| C. | 碳酸氫鈣溶液與鹽酸溶液反應 HCO3-+H+=H2O+CO2↑ | |
| D. | 向稀鹽酸溶液中加鐵粉 3Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com