
科目:高中化學 來源: 題型:
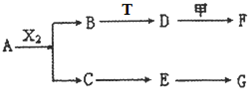 下列物質有如下轉化關系(有的生成物未列出,反應條件均省略),其中:A在常溫下是一種氣體,能使濕潤的紅色石蕊試紙顯藍色,D為堿,G為酸,金屬甲在G 的濃溶液中會鈍化;F的溶液中只含一種溶質.
下列物質有如下轉化關系(有的生成物未列出,反應條件均省略),其中:A在常溫下是一種氣體,能使濕潤的紅色石蕊試紙顯藍色,D為堿,G為酸,金屬甲在G 的濃溶液中會鈍化;F的溶液中只含一種溶質.
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
Ⅰ.甲、乙、丙、丁、戊具有如圖所示的結構或結構單元,圖中四面體外可能有的部分未畫出,只有實線表示共價鍵,X、Y可同可不同。
已知:甲、乙晶體類型相同,單質甲能與乙發生置換反應,丙、丁、己三種粒子均含有等量的總電子數,其中丙、己是同一類晶體中的分子,己在常溫下呈液態,能產生兩種10電子的離子,丁是陽離子且與丙符合“等電子原理”(具有相同電子數和原子數的分子或離子互稱為等電子體),戊通常為氣體與丙結構相似,但分子中多了24個價電子。
(1)寫出液態己產生兩種等電子粒子的電離方程式: 。
(2)X、Y原子的最外層都滿足8電子的分子是 (填字母代號)
A.甲 B.乙 C.丙 D.戊 E.己
(3)寫出甲與乙發生置換反應的反應方程式: 。
(4)丙是目前重要的能源之一。
① 丙和己在催化、加熱條件下得到可燃性的兩種氣體,其反應的化學方程式是: 。
② 現代高能電池中,常用丙作燃料電池的原料,在堿性介質(KOH溶液)的情況下,其正極反應的電極方程式為 。
(5)請寫出一種與戊符合“等電子原理”的離子 。
Ⅱ.A 、B 、C 、D 、E 五種短周期元素,原子序數依次增大.A、D同主族,A 與B 、C 分別構成電子數相等的化合物w、k,且w是一種能產生溫室效應的氣體;D 元素最外層電子數是次外層電子數的3 倍;A 、B 、C 、D 可形成化合物x;A 、D 、E 可形成化合物y;A 、C 、D 可形成化合物z.x、y、z 均為陽離子和陰離子個數比是1 : 1 的離子化合物.回答下列問題:
(1)y的電子式為_________________;w屬于______ (填“極性”或“非極性)分子;
(2)與E 同主族且為第七周期的元素原子序數為_________________;
(3)在同主族氫化物的性質遞變中,k 的沸點反常,這可以用__________來解釋(填字母序號);
A.共價健 B.離子鍵 C.氫鍵 D.范德瓦耳斯力
(4)常溫下,x 與y以物質的量之比1 : 2 反應后所得溶液顯_______(填“酸”、“堿”或“中”)性,由產物分析,原因是________________________(用離子方程式表示);
(5)由k與D 的單質、KOH 溶液構成原電池,負極會產生C 的單質。則其負極反應為______________________________;一段時間后,溶液pH__________(填“增大”、“減小”或“不變” )。
查看答案和解析>>
科目:高中化學 來源:2011屆四川成都外國語學校高三10月月考化學卷 題型:填空題
Ⅰ.甲、乙、丙、丁、戊具有如圖所示的結構或結構單元,圖中四面體外可能有的部分未畫出,只有實線表示共價鍵,X、Y可同可不同。
已知:甲、乙晶體類型相同,單質甲能與乙發生置換反應,丙、丁、己三種粒子均含有等量的總電子數,其中丙、己是同一類晶體中的分子,己在常溫下呈液態,能產生兩種10電子的離子,丁是陽離子且與丙符合“等電子原理”(具有相同電子數和原子數的分子或離子互稱為等電子體),戊通常為氣體與丙結構相似,但分子中多了24個價電子。
(1)寫出液態己產生兩種等電子粒子的電離方程式: 。
(2)X、Y原子的最外層都滿足8電子的分子是 (填字母代號)
A.甲 B.乙 C.丙 D.戊 E.己
(3)寫出甲與乙發生置換反應的反應方程式: 。
(4)丙是目前重要的能源之一。
①丙和己在催化、加熱條件下得到可燃性的兩種氣體,其反應的化學方程式是: 。
②現代高能電池中,常用丙作燃料電池的原料,在堿性介質(KOH溶液)的情況下,其正極反應的電極方程式為 。
(5)請寫出一種與戊符合“等電子原理”的離子 。
Ⅱ.A 、B 、C 、D 、E 五種短周期元素,原子序數依次增大.A、D同主族,A 與B 、C 分別構成電子數相等的化合物w、k,且w是一種能產生溫室效應的氣體;D 元素最外層電子數是次外層電子數的3 倍;A 、B 、C 、D 可形成化合物x;A 、D 、E 可形成化合物y;A 、C 、D 可形成化合物z.x、y、z 均為陽離子和陰離子個數比是1 : 1 的離子化合物.回答下列問題:
(1)y的電子式為_________________;w屬于______ (填“極性”或“非極性)分子;
(2)與E 同主族且為第七周期的元素原子序數為_________________;
(3)在同主族氫化物的性質遞變中,k 的沸點反常,這可以用__________來解釋(填字母序號);
A.共價健 B.離子鍵 C.氫鍵 D.范德瓦耳斯力
(4)常溫下,x 與y以物質的量之比1 : 2 反應后所得溶液顯_______(填“酸”、“堿”或“中”)性,由產物分析,原因是________________________(用離子方程式表示);
(5)由k與D 的單質、KOH 溶液構成原電池,負極會產生C 的單質。則其負極反應為______________________________;一段時間后,溶液pH__________(填“增大”、“減小”或“不變” )。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com