
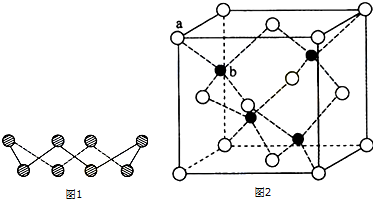
分析 (1)根據圖片知,每個S原子含有2個σ鍵和2個孤電子對,根據價層電子對互斥理論確定S原子雜化方式;
(2)同一主族元素,元素原子失電子能力隨著原子序數的增大而增強,原子失電子能力越強,其第一電離能越小;
(3)Se元素34號元素,M電子層上有18個電子,分別位于3s、3p、3d能級上;
(4)非金屬性越強的元素,其與氫元素的結合能力越強,則其氫化物在水溶液中就越難電離,酸性就越弱;
根據價層電子對互斥理論確定氣態SeO3分子的立體構型、SO32-離子的立體構型;
(5)①第一步電離后生成的負離子,較難再進一步電離出帶正電荷的氫離子;
②根據中心元素Se的化合價可以判斷電性高低,電性越高,對Se-O-H中O原子的電子吸引越強,越易電離出H+;
(6)利用均攤法計算晶胞中Zn、S原子數目,進而計算晶胞質量,再根據ρ=$\frac{m}{V}$計算晶胞密度;
b位置黑色球與周圍4個白色球構成正四面體結構,黑色球與兩個白色球連線夾角為109°28′,計算a位置白色球與面心白色球距離,設a位置S2-與b位置Zn2+之間的距離,由三角形中相鄰兩邊、夾角與第三邊關系:a2+b2-2abcosθ=c2計算.
解答 解:(1)根據圖片知,每個S原子含有2個σ鍵和2個孤電子對,所以每個S原子的價層電子對個數是4,則S原子為sp3雜化;
故答案為:sp3;
(2)同一主族元素,元素原子失電子能力隨著原子序數的增大而增強,原子失電子能力越強,其第一電離能越小,所以第一電離能大小順序:O>S>Se,故答案為:O>S>Se;
(3)Se元素34號元素,M電子層上有18個電子,分別位于3s、3p、3d能級上,所以其核外M層電子的排布式為3s23p63d10;
故答案為:34;3s23p63d10;
(4)非金屬性越強的元素,其與氫元素的結合能力越強,則其氫化物在水溶液中就越難電離,酸性就越弱,非金屬性S>Se,所以H2Se的酸性比H2S強,氣態SeO3分子中Se原子價層電子對個數是3且不含孤電子對,所以其立體構型為平面三角形,SO32-離子中S原子價層電子對個數=3+$\frac{1}{2}$(6+2-3×2)=4且含有一個孤電子對,所以其立體構型為三角錐形;
故答案為:強;平面三角形;三角錐形;
(5)①第一步電離后生成的負離子,較難再進一步電離出帶正電荷的氫離子,故H2SeO3和H2SeO4第一步電離程度大于第二步電離;
故答案為:第一步電離后生成的負離子,較難再進一步電離出帶正電荷的氫離子;
②H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2,H2SeO3中的Se為+4價,而H2SeO4中的Se為+6價,正電性更高,導致Se-O-H中O的電子更向Se偏移,越易電離出H+,H2SeO4比H2SeO3酸性強,
故答案為:H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2.H2SeO3中的Se為+4價,而H2SeO4中的Se為+6價,正電性更高,導致Se-O-H中O的電子更向Se偏移,越易電離出H+;
(6)晶胞中含有白色球位于頂點和面心,共含有8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球位于體心,共4個,則晶胞中平均含有4個ZnS,質量為4×(87÷6.02×1023)g,晶胞的體積為(540.0×10-10cm)3,則密度為[4×(87÷6.02×1023)g]÷(540.0×10-10cm)3=4.1g•cm-3;
b位置黑色球與周圍4個白色球構成正四面體結構,黑色球與兩個白色球連線夾角為109°28′,a位置白色球與面心白色球距離為540.0pm×$\frac{\sqrt{2}}{2}$=270$\sqrt{2}$pm,設a位置S2-與b位置Zn2+之間的距離為y pm,由三角形中相鄰兩邊、夾角與第三邊關系:y2+y2-2y2cos109°28′=(270$\sqrt{2}$)2,解得y=$\frac{270.0}{\sqrt{1-cos109°28′}}$,
故答案為:4.1;$\frac{270.0}{\sqrt{1-cos109°28′}}$;
點評 本題考查了較綜合,涉及粒子空間構型判斷、原子雜化方式判斷、元素周期律等知識點,根據價層電子對互斥理論、元素周期律等知識點來分析解答,注意(4)氫化物酸性強弱比較方法,為易錯點.


 寒假創新型自主學習第三學期寒假銜接系列答案
寒假創新型自主學習第三學期寒假銜接系列答案科目:高中化學 來源: 題型:選擇題
| A. | 數目為NA的一氧化碳分子和0.5 mol甲烷的質量比為7:4 | |
| B. | 標準狀況下,22.4 L水中含有水分子的數目為NA | |
| C. | 14 g N2中含有電子的數目為14NA | |
| D. | 2.3g Na完全反應時,轉移電子的數目為0.1 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
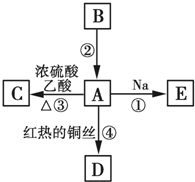 A、B、C、D、E均為有機物,其中A是化學實驗中最常見的有機物,它易溶于水并有特殊香味;B的產量可衡量一個國家石油化工發展的水平,有關物質的轉化關系如圖所示:
A、B、C、D、E均為有機物,其中A是化學實驗中最常見的有機物,它易溶于水并有特殊香味;B的產量可衡量一個國家石油化工發展的水平,有關物質的轉化關系如圖所示: CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在已知元素中具有最大的原子半徑 | B. | 在空氣中燃燒時生成氧化物Fr2O | ||
| C. | 氧化物對應的水化物是極強的堿 | D. | 其單質的熔點比金屬鈉的熔點低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增加鐵的量 | |
| B. | 將容器的體積縮小一半 | |
| C. | 壓強不變,充入氮氣使容器體積增大 | |
| D. | 加入催化劑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com