
【題目】(1)有封閉體系如下圖所示,左室容積為右室的兩倍,溫度相同,現分別按照如圖所示的量充入氣體,同時加入少量固體催化劑使兩室內氣體充分反應達到平衡,打開活塞,繼續反應再次達到平衡,下列說法正確的是____________

A.第一次平衡時,SO2的物質的量右室更多
B.通入氣體未反應前,左室壓強和右室一樣大
C.第一次平衡時,左室內壓強一定小于右室
D.第二次平衡時,SO2的總物質的量比第一次平衡時左室SO2的物質的量的2倍還要多
(2)有封閉體系如圖所示,甲、乙之間的隔板K和活塞F都可左右移動,先用小釘固定隔板K在如圖位置(0處),甲中充入1molN2和3molH2,乙中充入2molNH3和1molAr,此時F處于如圖6處。拔取固定K的小釘,在少量固體催化劑作用下發生可逆反應:N2(g)+ 3H2(g)![]() 2 NH3(g); 反應達到平衡后,再恢復至原溫度。回答下列問題:
2 NH3(g); 反應達到平衡后,再恢復至原溫度。回答下列問題:

① 達到平衡時,移動活塞F最終仍停留在0刻度右側6處,則K板位置范圍是________。
② 若達到平衡時,隔板K最終停留在0刻度處,則甲中NH3的物質的量為______mol, 此時,乙中可移動活塞F最終停留在右側刻度____處(填下列序號:①>8; ②<8; ③=8)
③ 若一開始就將K、F都固定,其它條件均不變,則達到平衡時測得甲中H2的轉化率為b,則乙中NH3的轉化率為_________;假設乙、甲兩容器中的壓強比用d表示,則d的取值范圍是_______________。
【答案】BC 0刻度左側0-2處 1 ① 1-b 5/4<d< 3/2
【解析】
(1)A. 根據2SO2 + O2 ![]() 2SO3,把2molSO3導入左邊相當于2molSO2, 1molO2,而左室體積大于右室,左室相對右室相當于減小壓強,平衡左移;
2SO3,把2molSO3導入左邊相當于2molSO2, 1molO2,而左室體積大于右室,左室相對右室相當于減小壓強,平衡左移;
B. 根據PV=nRT,左室氣體物質的量和體積均是右室的2倍,即壓強相等;
C. 根據2SO2 + O2 ![]() 2SO3,把2molSO3導入左邊相當于2molSO2 ,1molO2 ,而左室體積大于右室,左室相對右室相當于減小壓強,平衡左移;
2SO3,把2molSO3導入左邊相當于2molSO2 ,1molO2 ,而左室體積大于右室,左室相對右室相當于減小壓強,平衡左移;
D. 第二次平衡時,氣體體積變為左室體積的1.5倍,把2molSO3導入左邊相當于2molSO2 ,1molO2 ,物質的量變為2倍,比第一次平衡時壓強變大,平衡正向移動。
(2)①當乙中沒有Ar氣時,甲中充入1molN2和3molH2與乙中充入2molNH3到達平衡狀態時,為等效的,即兩邊氣體的物質的量相等,隔板應位于中間0處,此后向乙中再充入1molAr氣,會使乙中氣體壓強增大,隔板向甲的方向移動,會使甲中的反應向正向移動。
②根據題中條件,當達到平衡時,K停留在0處,說明乙端的相當有8個格。
③體積固定,恒溫、恒壓容器中,兩邊達到平衡的狀態相同,乙中的氬氣對平衡無影響;體積不變,兩邊轉化結果相同,H2的轉化率為b,則乙中NH3的轉化率為1-b;此題仍要考慮兩種極限情況,即乙、甲完全轉化與乙、甲完全不轉化。
(1)A. 根據2SO2 + O2 ![]() 2SO3,把2molSO3導入左邊相當于2molSO2, 1molO2,而左室體積大于右室,左室相對右室相當于減小壓強,平衡左移 ,生成的SO2的物質的量更多,故A錯誤。
2SO3,把2molSO3導入左邊相當于2molSO2, 1molO2,而左室體積大于右室,左室相對右室相當于減小壓強,平衡左移 ,生成的SO2的物質的量更多,故A錯誤。
B.根據PV=nRT,左室氣體物質的量和體積均是右室的2倍,即壓強相等,故B正確。
C. 根據2SO2 + O2 ![]() 2SO3,把2molSO3導入左邊相當于2molSO2 ,1molO2 ,而左室體積大于右室,左室相對右室相當于減小壓強,平衡左移,故左室內壓強一定小于右室,故C正確。
2SO3,把2molSO3導入左邊相當于2molSO2 ,1molO2 ,而左室體積大于右室,左室相對右室相當于減小壓強,平衡左移,故左室內壓強一定小于右室,故C正確。
D. 第二次平衡時,氣體體積變為左室體積的1.5倍,把2molSO3導入左邊相當于2molSO2 ,1molO2 ,物質的量變為2倍,比第一次平衡時壓強變大,平衡正向移動,生成的SO2的總物質的量比第一次平衡時左室SO2的物質的量的2倍少,故D錯誤。
故選BC。
(2)① 當乙中沒有Ar氣時,甲中充入1molN2和3molH2與乙中充入2molNH3到達平衡狀
態時,為等效的,即兩邊氣體的物質的量相等,隔板應位于中間0處,此后向乙中再充
入1molAr氣,會使乙中氣體壓強增大,隔板向甲的方向移動,會使甲中的反應向正向
移動,再次到達平衡時,隔板位于0刻度左側左處,通過觀察,當反應未開始時隔板位于0處,每一個格相當于0.5mol氣體,假設隔板K最終在a處,設甲中反應到達平衡時,有xmolN2發生反應
N2(g)+ 3H2(g)![]() 2 NH3(g)
2 NH3(g)
開始(mol) 1mol 3mol 0
轉化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
(1-x)+ (3-3x)+ 2x=(6-a) ×0.5a,0.5a=2x-1,當N2完全反應時,x=1,a取最大,a=2,根據可逆反應不能進行到底,可知:K停留在0刻度左側0-2處,故答案為:0刻度左側0-2處。
②根據題中條件,當達到平衡時,K停留在0處,說明乙端的相當有8個格,即乙中平衡時氣體的物質的量為4mol,其中Ar為1mol,設乙中達到平衡時有2ymol NH3反應,
2NH3(g) ![]() N2(g)+ 3H2(g)
N2(g)+ 3H2(g)
開始(mol) 2mol 0 0
轉化(mol) 2y y 3y
平衡(mol) 2-2y y 3y
2-2y +y + 3y=3,2y=1,甲中NH3的物質的量為1mol;
根據題中信息可知,甲和乙是在恒溫恒壓條件下的反應,屬于等效平衡,若平衡時K停留在0處,說明甲中平衡混合物為4mol,如乙平衡不移動,乙中為NH3和Ar,共3mol, 體積為8,故答案為:1;①。
③體積固定,恒溫、恒壓容器中,兩邊達到平衡的狀態相同,乙中的氬氣對平衡無影響;體積不變,兩邊轉化結果相同,H2的轉化率為b,則乙中NH3的轉化率為1-b;此題仍要考慮兩種極限情況,即乙、甲完全轉化與乙、甲完全不轉化,當乙完全不轉化、甲完全轉化時,恒容,d=P(乙)/ P(甲)=3/2, 當乙完全轉化、甲完全不轉化時,恒容,d=P(乙)/ P(甲)= 5/4,故答案為:1-b ; 5/4<d< 3/2。


科目:高中化學 來源: 題型:
【題目】已知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密閉容器中充入0.1molCH4和0.2molH2S,不斷升高溫度,測得平衡時體系中各物質的物質的量分數與溫度的關系如圖所示:
CS2(g)+4H2(g)。向恒容密閉容器中充入0.1molCH4和0.2molH2S,不斷升高溫度,測得平衡時體系中各物質的物質的量分數與溫度的關系如圖所示:

下列說法正確的是
A. 該反應的△H<0
B. 維持Z點溫度,向容器中再充入CH4、H2S、CS2、H2各0.1mol時,v(正)>v(逆)
C. X點與Y點容器內壓強比為51:55
D. X點CH4的轉化率為20%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某稀土元素R的精礦樣品中,R的氧化物的質量分數為0.8515。10.1g該樣品與50mL1mol/L硫酸恰好完全反應(雜質不反應),生成ROSO4和H2O,則R的相對原子質量約為
A. 78B. 140C. 156D. 172
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知N2O4(g)![]() 2NO2(g) ΔH=+57.20 kJ/mol,t℃時,將一定量的NO2、N2O4充入一個容積為2 L的恒容密閉容器中,濃度隨時間變化關系如下表所示:
2NO2(g) ΔH=+57.20 kJ/mol,t℃時,將一定量的NO2、N2O4充入一個容積為2 L的恒容密閉容器中,濃度隨時間變化關系如下表所示:
時間/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
下列推斷不正確的是
A. c(X)代表NO2的濃度
B. 20min時改變的條件是向容器中加入0.8molNO2
C. 該反應的平衡常數K=0.9 mol/L
D. 25min后混合氣體的平均摩爾質量為64.4g·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修3:物質結構與性質]
技術人員曬制藍圖時,用K3Fe(C2O4)3]·H2O(三草酸合鐵酸鉀)作感光劑,再以K3[Fe(CN)6]氰合鐵酸鉀)溶液作顯影劑。請回答以下問題:
(1)鐵元素在周期表中位置為___________,Fe3+的基態價電子排布圖為___________。
(2)在上述兩種鉀鹽中第一電離能最大的元素為___________,電負性最小的元素為___________。
(3)H2C2O4分子屮碳原子的雜化類型是___________,與C2O42-互為等電子體的分子的化學式為___________(寫一種)。
(4)在分析化學中F-常用于Fe3+的掩蔽劑,因為生成的FeF63-十分穩定,但Fe3+卻不能與I-形成配合物,其原因是______________________(用離子方程式來表示)。
(5)已知C60分子結構和C60晶胞如右圖所示:
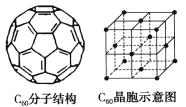
①1個C60分子中含有π鍵的數目為___________。
②晶胞中C60的配位數為___________。
③已知C60晶胞參數為apm,則該晶胞密度的表達式是___________g·cm-3(NA代表阿伏加德羅常數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將NO2裝入帶活塞的密閉容器中,當反應2NO2(g) ![]() N2O4(g)達到平衡后,改變下列一個條件,其中敘述錯誤的是( )
N2O4(g)達到平衡后,改變下列一個條件,其中敘述錯誤的是( )
A. 升高溫度,氣體顏色加深,則此正反應為吸熱反應
B. 慢慢壓縮氣體體積,平衡向右移動,混合氣體顏色較原來深
C. 慢慢壓縮氣體使體積減小一半,壓強增大,但小于原來的兩倍
D. 恒溫恒容時,充入惰性氣體,壓強增大,平衡不會移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,可逆反應A(g) + B(g) ![]() mC(g)變化如圖所示。已知縱坐標表示在不同溫度和壓強下生成物C在混合物中的質量分數,p為反應在T2溫度時達到平衡后向容器加壓的變化情況,下列說法正確的是( )
mC(g)變化如圖所示。已知縱坐標表示在不同溫度和壓強下生成物C在混合物中的質量分數,p為反應在T2溫度時達到平衡后向容器加壓的變化情況,下列說法正確的是( )

A. T1 < T2
B. 正反應是放熱反應
C. m<2
D. 恒溫、恒容充入稀有氣體,平衡逆向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列不能用勒夏特列原理解釋的是
A. 開啟汽水瓶后,瓶中馬上泛起大量泡沫
B. Cl2(HCl)要除去其中的HCl,將其通過飽和食鹽水
C. 在N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0 中,反應條件是高溫、高壓催化劑
2NH3(g) ΔH<0 中,反應條件是高溫、高壓催化劑
D. SO2催化氧化成SO3的反應,往往需要使用過量的空氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值,下列說法正確的是
A. 1molHClO中所含H—Cl鍵的數目為NA
B. 8.8g乙酸乙酯中所含碳原子數為0.4NA
C. 1.2gC與0.1molCO2在高溫下充分反應生成的CO分子數為0.1NA
D. 標準狀況下,1L0.1mol·L-1HCl溶液中滴加氨水至pH=7,溶液中![]() 的數目為0.1NA
的數目為0.1NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com