
| A. | AgCl在飽和NaCl溶液中的Ksp比在純水中的小 | |
| B. | 向AgCl的懸濁液中加入NaBr溶液,白色沉淀轉化為淡黃色,說明Ksp(AgCl)<Ksp(AgBr) | |
| C. | 將0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,無沉淀析出 | |
| D. | 向AgCl的懸濁液中滴加濃氨水,沉淀溶解,說明AgCl的溶解平衡向右移動 |
分析 A.KSP只與溫度有關,溫度不變,則溶度積不變;
B.沉淀轉化為溶解度更小的物質容易發生;
C.計算出銀離子與氯離子的濃度濃度商Qc,然后與與KSP比較;
D.銀離子與氨水生成氫氧化二氨合銀.
解答 解:A.KSP只與溫度有關,與溶液中離子濃度無關,所以AgCl在飽和NaCl溶液中的Ksp與在純水的相等,故A錯誤;
B.沉淀轉化為溶解度更小的物質容易發生,向AgCl的懸濁液中加入NaBr溶液,白色沉淀轉化為淡黃色,說明KSP(AgCl)>KSP(AgBr),故B錯誤;
C.在AgCl飽和溶液中,Qc(AgCl)=c(Ag+)•c(Cl-)=0.001mol•L-1×0.001mol•L-1=1×10-6mol2•L-2>1.8×10-10mol2•L-2,所以混合液中會產生沉淀,故C錯誤;
D.銀離子與氨水生成氫氧化二氨合銀,使平衡向右移動,故D正確;
故選D.
點評 本題綜合考查難溶電解質的溶解平衡,為高頻考點,題目難度中等,側重于計算以及概念理解的考查,注意把握計算公式的應用,試題培養了學生的靈活應用能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 利用下圖裝置測定中和熱的實驗步驟如下:
利用下圖裝置測定中和熱的實驗步驟如下:| 溫度 實驗次數 | 起始溫度t1℃ | 終止溫度t2/℃ | 溫度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
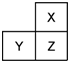 X、Y、Z是三種短周期的主族元素,在周期表中的位置如圖,X原子的最外層電子數是其次外層電子數的3倍,下列說法正確的是( )
X、Y、Z是三種短周期的主族元素,在周期表中的位置如圖,X原子的最外層電子數是其次外層電子數的3倍,下列說法正確的是( )| A. | 氣態氫化物的熱穩定性:X>Z | |
| B. | 原子半徑:X<Y<Z | |
| C. | Y和Z的最高價氧化物對應水化物均為強酸 | |
| D. | 若Z的最高正價為+m,則X的最高正價也一定為+m |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com