
【題目】鋇(Ba)和鍶(Sr)及其化合物在工業上有著廣泛的應用,它們在地殼中常以硫酸鹽的形式存在,BaSO4和SrSO4都是難溶性鹽。工業上提取鋇和鍶時首先將![]() 和
和![]() 轉化成難溶弱酸鹽。
轉化成難溶弱酸鹽。
已知:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)將SrSO4轉化成SrCO3的離子方程式為:_______________________________________,該反應的平衡常數表達式為_____________________________________;該反應能發生的原因是:________________________________。(用沉淀溶解平衡的有關理論解釋)
(2)對于上述反應,實驗證明增大CO32-的濃度或降低溫度都有利于提高SrSO4的轉化率。判斷在下列兩種情況下,平衡常數K的變化情況(填“增大”“減小”或“不變”):
①升高溫度,平衡常數K將__________________________________;
②增大CO32-的濃度,平衡常數K將________。
(3)已知,SrSO4和SrCO3在酸中的溶解性與BaSO4和BaCO3類似,設計實驗證明上述過程中SrSO4是否完全轉化成SrSO4。實驗所用的試劑為________;實驗現象及其相應結論為______________________。
【答案】![]()
![]()
![]()
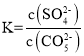
![]() ,加
,加![]() 后,平衡
后,平衡![]()
![]()
![]() 正向移動,生成SrCO3 減小 不變 鹽酸 若沉淀完全溶解,則證明SrSO4完全轉化成SrCO3,否則,未完全轉化
正向移動,生成SrCO3 減小 不變 鹽酸 若沉淀完全溶解,則證明SrSO4完全轉化成SrCO3,否則,未完全轉化
【解析】
(1)SrSO4轉化成SrCO3的原因是依據物質溶解度的不同實現,反應向更難溶的方向進行;依據沉淀轉化的反應方程式結合平衡常數概念寫出表達式即可,依據溶解平衡的有關理論解釋即可;
(2)①、平衡常數隨溫度變化,反應是放熱反應,升溫平衡逆向進行;
②、平衡常數不隨濃度變化;
(3)、依據SrSO4和SrCO3在酸中的溶解性與BaSO4和BaCO3類似,說明SrCO3溶于酸,SrSO4不溶于酸,據此設計實驗驗證物質成分。
(1)、依據物質Ksp大小可知,SrSO4轉化成SrCO3的溶解性不同,反應向更難溶的方向進行,依據沉淀轉化寫出離子方程式為:![]()
![]()
![]() ;該反應為的溶解平衡常數為:
;該反應為的溶解平衡常數為: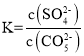 ;該反應能發生的原因是Ksp(SrCO3)< Ksp(SrSO4),加入CO32-后,平衡
;該反應能發生的原因是Ksp(SrCO3)< Ksp(SrSO4),加入CO32-后,平衡![]()
![]()
![]() 正向移動,生成SrCO3,故答案為:
正向移動,生成SrCO3,故答案為:![]()
![]()
![]() ;
;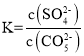 ;
;![]() ,加
,加![]() 后,平衡
后,平衡![]()
![]()
![]() 正向移動,生成SrCO3;
正向移動,生成SrCO3;
(2)①、實驗證明降低溫度都有利于提高SrSO4的轉化率,說明平衡正向進行,正反應為放熱反應,所以升高溫度平衡逆向進行,平衡常數K減小,故答案為:減小;
②、增大CO32-的濃度平衡正向進行,平衡常數隨溫度變化,不隨濃度改變,所以平衡常數不變,故答案為:不變;
(3)、SrSO4和SrCO3在酸中的溶解性與BaSO4和BaCO3類似,說明SrCO3溶于酸,SrSO4不溶于酸,證明上述過程中SrSO4是否完全轉化成SrCO3,實驗所用試劑為鹽酸;若沉淀完全溶解,則證明SrSO4完全轉化成SrCO3,否則為不完全轉化,故答案為:鹽酸;若沉淀完全溶解,則證明SrSO4完全轉化成SrCO3,否則為不完全轉化。


 通城學典默寫能手系列答案
通城學典默寫能手系列答案科目:高中化學 來源: 題型:
【題目】已知反應![]() 是可逆反應.設計如圖裝置
是可逆反應.設計如圖裝置![]() 、
、![]() 均為石墨電極
均為石墨電極![]() ,分別進行下述操作.
,分別進行下述操作.
I向B燒杯中逐滴加入濃鹽酸
![]() 向B燒杯中逐滴加入
向B燒杯中逐滴加入![]() 溶液結果發現電流計指針均發生偏轉.
溶液結果發現電流計指針均發生偏轉.
據此,下列判斷正確的是![]()
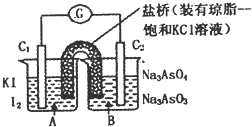
A.操作I過程中,![]() 為正極
為正極
B.操作II過程中,鹽橋中的![]() 移向B燒杯溶液
移向B燒杯溶液
C.I操作過程中,![]() 棒上發生的反應為:
棒上發生的反應為:![]()
D.II操作過程中,![]() 棒上發生的反應為:
棒上發生的反應為:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )

下列圖示與對應的敘述符合的是( )
A.圖甲實線、虛線分別表示某可逆反應未使用催化劑和使用催化劑的正、逆反應速率隨時間的變化
B.圖乙表示反應2SO2(g)+O2(g) ![]() 2SO3(g)△H<0的平衡常數K與溫度和壓強的關系
2SO3(g)△H<0的平衡常數K與溫度和壓強的關系
C.圖丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液時,溶液中 隨HCl溶液體積變化關系
隨HCl溶液體積變化關系
D.圖丁表示常溫下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH隨NaOH溶液體積的變化關系
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.用標準NaOH溶液滴定充滿HCl的燒瓶(標況下,燒瓶容積為V L)做完噴泉實驗后得到的稀鹽酸(水充滿整個燒瓶)以測定它的準確濃度,用酚酞作指示劑。請你回答下列問題:
(1)計算該鹽酸的物質的量濃度為:_____。(保留三位有效數字)
(2)現有三種濃度的標準NaOH溶液,你認為最合適的是下列第_____種。
①5.00molL﹣1②0.500molL﹣1③0.0500molL﹣1
(3)若采用上述最合適濃度的標準NaOH溶液滴定,滴定時實驗數據列表如下:
實驗次數編號 | 待測鹽酸體積(mL) | 滴入NaOH溶液體積(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求這種待測稀鹽酸的物質的量濃度c(HCl)=_____。與理論計算值比較,造成的誤差的原因可能是哪些下列操作導致的_____
①滴定前平視,滴定終了俯視
②滴定管(裝標準溶液)在滴定前尖嘴處有氣泡,滴定終了無氣泡
③滴定管用蒸餾水洗凈后,未用已知濃度的標準溶液潤洗
④看到顏色變化后立即讀數 ⑤洗滌錐形瓶時,誤把稀食鹽水當做蒸餾水進行洗滌
II.測定綠礬FeSO4·xH2O中結晶水含量
Ⅰ.準確稱量27.8 g綠礬樣品,配成250 mL溶液;
Ⅱ.量取25.00 mL所配制的溶液于錐形瓶中;
Ⅲ.用硫酸酸化的0.100 0 mol·L1 KMnO4溶液滴定至終點;
Ⅳ.重復操作3次,消耗KMnO4溶液的體積分別為20.02 mL、24.98 mL、19.98 mL。
(1)判斷達到滴定終點時的實驗現象是_____。
(2)根據實驗記錄,計算綠礬化學式中結晶水數目x=__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學方程式中,不能正確表達反應顏色變化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液藍色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出現白色固體Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空氣中放置后由淡黃色變為白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2懸濁液中滴加足量FeCl3溶液出現紅褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A | B | C | D |
通電一段時間后,攪拌均勻,溶液的pH增大 | 此裝置可實現 銅的精煉 | 鹽橋中的K+ 移向FeCl3溶液 | 若觀察到甲燒杯中石墨電極附近先變紅,則乙燒杯中銅電極為陽極 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,在25 mL0.1mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH與CH3COOH 溶液體積關系如圖所示。下列有關粒子濃度關系正確的是

A. 曲線上A、B間的任意一點:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B點:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C點:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. D點:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知草酸鎳晶體(NiC2O4·2H2O)難溶于水,工業上從廢鎳催化劑(主要成分為Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制備草酸鎳晶體的流程如圖所示:

已知:①相關金屬離子生成氫氧化物沉淀的pH見表中數據:
金屬離子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
開始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③當某物質濃度小于1.0×10-5 mol·L-1時,視為完全沉淀。
請回答下列問題:
(1)請寫出一種能提高“酸浸”速率的措施:_______________________________。
(2)試劑a是一種綠色氧化劑,寫出“氧化”時反應的離子方程式:_____________。
(3)“調pH”時pH的調控范圍為__________________。
(4)寫出“沉鎳”時發生反應的離子方程式:________________________________,證明Ni2+已經沉淀完全的實驗步驟及現象是______________________________,當Ca2+沉淀完全時,溶液中c(F-)>____________mol·L-1(寫出計算式即可)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com