
CH4(g)+H2O(g)![]() CO(g)+3H2(g);ΔH>0
CO(g)+3H2(g);ΔH>0
請根據題目要求回答下列問題。
(1)在一定條件下,將0.05molCH4和0.10molH2O氣放入容積
(2)在其他條件不變的情況下降低溫度,則逆反應速率__________(填“增大”“減小”或“不變”,下同);在其他條件不變的情況下加壓,則正反應速率____________________。
(3)在一定條件下,當該反應處于化學平衡狀態時,下列操作可使化學平衡向正反應方向移動的是__________(填序號)。
A.升高溫度 B.降低溫度 C.增大壓強 D.減小壓強 E.加入催化劑 F.移出水蒸氣
(4)在一定溫度下,將1.0 mol CH4和2.0molH2O(g)通入某一恒壓容器中,達到化學平衡時,混合氣共4.0mol,則CH4的轉化率為___________;若其他條件不變,起始時加入amol CH4、bmol H2O(g)、cmolCO和dmolH2,達到平衡時,各組分體積分數與上述平衡完全相等,則a、b和c滿足的關系為___________(用字母表示)。
(1)![]() =7.5×10-4mol·(L·s)-1或
=7.5×10-4mol·(L·s)-1或![]() ×10-3mol·(L·s)-1或0.00075mol·(L·s)-1(注:不寫單位不可)
×10-3mol·(L·s)-1或0.00075mol·(L·s)-1(注:不寫單位不可)
(2)減小 增大
(3)A、D
(4)50%
【解析】本題考查了化學反應速率v的計算,影響v的因素及化學平衡因素,等效平衡。v(H2)=3v(CO)=![]() ×3=7.5×10-4mol·(L·s)-1。
×3=7.5×10-4mol·(L·s)-1。
因為溫度和壓強對v正和v逆的影響是同時變大或變小。因此對此反應降溫,v逆減小,加壓v正增大。由于ΔH>0,正方向為吸熱反應,反應物氣體化學計量數小于生成物化學計量數,正方向為體積擴大的反應,所以A和D符合。求CH4的轉化率,要求CH4反應的物質的量,設CH4反應的物質的量為x。
CH4 + H2O ![]() CO+3H2
CO+3H2
開始:1.0mol 2.0mol 0 0
平衡:(1.0mol-x) (2.0-x) x 3x
得x=0.5mol
轉化率為![]() ×100%=50%。
×100%=50%。
根據等效平衡


 高中必刷題系列答案
高中必刷題系列答案科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源:2012-2013學年四川省綿陽市第三次診斷性考試理綜化學試卷(解析版) 題型:填空題
尿素[CO(NH2)2]是一種非常重要的高氮化肥,以天然氣(含H2S)為原料 合成尿素的主要步驟如下圖所示(圖中某些轉化步驟未列出)。

請回答下列問題:
(1)反應①的離子方程式是______________
(2)天然氣脫硫后產生的Fe2S3和H2O與02反應的化學方程式是_______。
(3)反應②是放熱反應,溫度升高,該反應的平衡常數_______ (填 “增大”、“減小” 或“不變”)。H2NCOONH4 (氨基甲酸銨)是合成尿素的中間體,其中碳原子的雜化軌道類型是_______雜化。
(4)如果整個生產過程釆用綠色化學工藝,則生產 120t尿素理論上需要 CH4___m3 (標準狀況)。
(5)化學家正在研究尿素動力燃料電池,尿液也能發電!用這種電池直接去除城市廢水中的尿素,既能產生凈化的水又能發電。尿素燃料電池結構如圖所示,工作時負極的電極反應式為__________
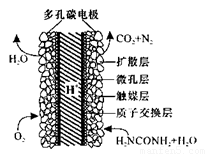
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com