
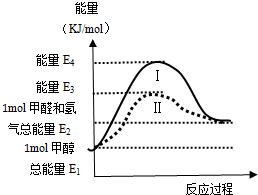
 甲醇是重要的化工原料,氣態甲醇催化脫氫制備甲醛轉化的能量關系如圖所示.
甲醇是重要的化工原料,氣態甲醇催化脫氫制備甲醛轉化的能量關系如圖所示.分析 (1)反應物的總能量比生成物的總能量低,為吸熱反應,反之為放熱反應,通過比較反應物和生成物的總能量的角度來得出反應吸熱;反應熱取決于反應物和生成物的總能量的大小,與起始狀態和反應的最終狀態有關,而與反應的途徑無關;E4-E3為降低了反應的活化能值;
(2)已知:(i)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
(ii)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
(iii)2CO(g)+O2(g)?2CO2(g) )△H3=-566.0kJ•mol-1
根據蓋斯定律,i×2+2×ii+iii可得:2CH4(g)+O2(g)?2CH3OH(g);
(3)原電池負極發生氧化反應,甲醇在負極失去電子,堿性條件下生成碳酸根離子與水;
(4)電解法精煉銅時,粗銅作陽極,與電源的正極相連,主要反應為銅失去電子,純銅作陰極,與電源的負極相連;若用該電池電解精煉銅,依據串聯電路中各個電極轉移電子數相同,依據電子守恒計算理論上需要甲醇的質量.
解答 解:(1)通過圖象可以看出,反應物的總能量比生成物的總能量低,故為吸熱反應,一個化學反應的熱效應僅與反應的起始狀態和反應的最終狀態有關,與反應的途徑無關,僅取決于反應物和生成物的總能量的大小,過程Ⅰ與過程Ⅱ的反應熱是相同的,過程Ⅱ與過程Ⅰ比較活化能減小,E4-E3為降低了反應的活化能值,
故答案為:吸熱;相同;降低的活化能值;
(2)已知:(i)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
(ii)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
(iii)2CO(g)+O2(g)?2CO2(g) )△H3=-566.0kJ•mol-1
根據蓋斯定律,i×2+2×ii+iii可得:得2CH4(g)+O2(g)?2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ•mol-1)×2+(-90.1kJ•mol-1)×2+(-566.0kJ•mol-1)=-251.6kJ•mol-1,所以用CH4和O2直接制備甲醇蒸氣的熱化學方程式為2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1,
故答案為:2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1;
(3)原電池負極發生氧化反應,甲醇在負極失去電子,堿性條件下生成碳酸根離子與水,負極電極反應式為:CH3OH-6e-+8OH-=CO32-+6H2O,正極上氧氣得電子發生還原反應,電極反應式為O2+4e-+4H+=2H2O,
故答案為:CH3OH-6e-+8OH-=CO32-+6H2O;
(4)電解精煉銅時,粗銅應作陽極,電解池的陰極材料是純銅,陽極主要電極反應為:Cu-2e-=Cu2+,電極反應為:Cu2++2e-=Cu,Fe、Zn比Cu活潑,故Fe、Zn在陽極比Cu更容易失去電子,變成Fe2+、Zn2+進入溶液;在陰極,Fe2+、Zn2+比Cu2+難于得到電子,因此不能在陰極析出,最終留在溶液中,Cu比Ag、Au活潑,故Ag、Au在陽極比Cu難于失去電子,因此不能溶解進入溶液,最終以陽極泥的形式沉淀出來,所以電解精煉銅,陰極電極反應為:Cu2++2e-=Cu,每轉移2mol電子,析出64g銅,所以陰極質量增重19.2g時,轉移電子數為:$\frac{19.2g}{64g/mol}$×2=0.6mol,電池與電解池為串聯,所以當電解池中轉移0.6mol電子,電池中轉移電子數為0.6mol,依據CH3OH-6e-+8OH-=CO32-+6H2O可知需0.1mol甲醇,質量為m=nM=0.1mol×32g/mol=3.2g,
故答案為:3.2.
點評 本題主要考查了反應中能量的變化、熱化學方程式的書寫、電解池工作原理及相關計算,理清甲醇和氫氣的熱量關系、熟悉原電池、電解池工作原理及各個電極發生反應是解答本題的關鍵,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHSO4═Na++HSO4- | D. | KClO3═K++Cl-+3O2- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 1 | NaCl | NaHCO3 | NH4Cl |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/K | 反應I | 反應II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
科學家利用太陽能分解水生成的氫氣在催化劑作用下與二氧化碳反應生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.0×10-6mol/L | B. | 3.2×10-6mol/L | C. | 2.0×10-9mol/L | D. | 3.2×10-9mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com