

分析 硫鐵礦燒渣加入硫酸后金屬氧化物反應生成硫酸亞鐵、硫酸鐵,酸性氧化物SiO2不能發生反應,過濾后得到的濾渣為二氧化硅,濾液中加入過量鐵粉,硫酸鐵發生反應生成硫酸亞鐵溶液,調節pH后加入碳酸氫銨溶液,可生成碳酸亞鐵固體,經洗滌、干燥,在空氣中灼燒時發生分解,且與空氣中的氧氣發生氧化還原反應,可生成氧化鐵.(1)酸溶過程中四氧化三鐵和酸反應生成亞鐵離子、鐵離子和水;
(2)根據分析可知,步驟Ⅱ為過濾,過濾操作所用的玻璃儀器有漏斗、玻璃棒和燒杯等,步驟Ⅳ中調節pH值的試劑要能與酸反應且不引入新的雜質,由于加入了NH4HCO3溶液,所以溶液中含有NH4+;
(3)步驟Ⅲ是將鐵離子還原成亞鐵離子,檢驗步驟Ⅲ已經進行完全,即溶液中沒有鐵離子;
(4)步驟Ⅵ中發生反應為碳酸亞鐵在空氣中與氧氣發生氧化還原反應,可生成氧化鐵;
(5)由題中數據可知,溶液中c(Fe2+)•c2(OH-)=1×10-6×(1×10-4.5)2=1×10-15>Ksp[Fe(OH)2]=4.9×10-17,故有Fe(OH)2沉淀生成;
(6)根據題意,最后稱得殘留固體4.2g為氧化鐵,可計算鐵元素的質量,由鐵元素守恒可知樣品中鐵元素的質量,以此計算質量分數.
解答 解:硫鐵礦燒渣加入硫酸后金屬氧化物反應生成硫酸亞鐵、硫酸鐵,酸性氧化物SiO2不能發生反應,過濾后得到的濾渣為二氧化硅,濾液中加入過量鐵粉,硫酸鐵發生反應生成硫酸亞鐵溶液,調節pH后加入碳酸氫銨溶液,可生成碳酸亞鐵固體,經洗滌、干燥,在空氣中灼燒時發生分解,且與空氣中的氧氣發生氧化還原反應,可生成氧化鐵,
(1)酸溶過程中四氧化三鐵和酸反應生成亞鐵離子、鐵離子和水,“酸溶”過程中Fe3O4發生反應的離子方程式為Fe3O4+8H+=Fe2++2Fe3++4H2O,
故答案為:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(2)根據分析可知,步驟Ⅱ為過濾,過濾操作所用的玻璃儀器有漏斗、玻璃棒和燒杯等,步驟Ⅳ中調節pH值的試劑要能與酸反應且不引入新的雜質,由于加入了NH4HCO3溶液,所以溶液中含有NH4+,故用氨水較好,選項D正確,
故答案為:漏斗;D;
(3)步驟Ⅲ是將鐵離子還原成亞鐵離子,檢驗步驟Ⅲ已經進行完全,即溶液中沒有鐵離子,可以用KSCN溶液.
故答案為:KSCN溶液;
(4)步驟Ⅵ中發生反應為碳酸亞鐵在空氣中與氧氣發生氧化還原反應,可生成氧化鐵,反應方程式為4FeCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+4CO2,
故答案為:4FeCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+4CO2;
(5)由題中數據可知,溶液中c(Fe2+)•c2(OH-)=1×10-6×(1×10-4.5)2=1×10-15>Ksp[Fe(OH)2]=4.9×10-17,故有Fe(OH)2沉淀生成,
故答案為:有;溶液中c(Fe2+)•c(OH-)2=1×10-6×(1×10-4.5)2=1×10-15>Ksp[Fe(OH)2]=4.9×10-17,故有Fe(OH)2沉淀生成;
(6)根據題意,最后稱得殘留固體4.2g為氧化鐵,則鐵元素的質量為$\frac{112}{160}$×4.2g=2.94g,根據鐵元素守恒可知樣品中鐵元素的質量為2.94g,所以樣品中Fe元素的質量分數為$\frac{2.94g}{5.6g}$×100%=52.5%,
故答案為:52.5%.
點評 本題考查物質的制備實驗,為高頻考點,把握制備流程、物質的性質、發生的反應為解答的關鍵,側重分析與實驗、計算能力的綜合考查,題目難度中等.


科目:高中化學 來源: 題型:解答題
 (1)配置混合溶液時,加入試劑的正確順序是A(填“A”或“B”);
(1)配置混合溶液時,加入試劑的正確順序是A(填“A”或“B”);查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
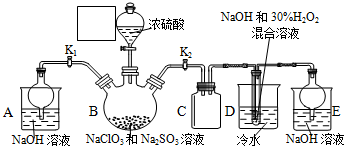
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
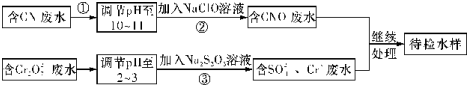
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
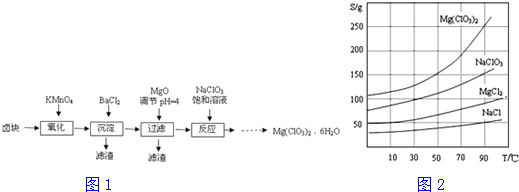
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 糖類是具有甜味的物質 | |
| B. | 糖類是人體必需的營養素 | |
| C. | 葡萄糖是一種多羥基醛,不具有還原性 | |
| D. | 糖類是具有Cn(H2O)m通式的物質,糖也稱為碳水化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在該反應中有1 mol H2C2O4參加反應,轉移電子總數為6NA | |
| B. | 該反應配平后H+的化學計量數為6 | |
| C. | 該反應右邊橫線上的產物為OH- | |
| D. | 該反應的氧化劑為H2C2O4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com