
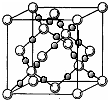
 (2013?常州一模)A、B、C、D、E、F為原子序數依次增大的短周期主族元素.A、F原子的最外層電子數均等于其周期序數,F原子的電子層數是A的3倍;B原子核外電子分處3個不同能級,且每個能級上排布的電子數相同;A與C形成的最簡單分子為三角錐形;D原子p軌道上成對電子數等于未成對電子數;E原子核外每個原子軌道上的電子都已成對,E電負性小于F.
(2013?常州一模)A、B、C、D、E、F為原子序數依次增大的短周期主族元素.A、F原子的最外層電子數均等于其周期序數,F原子的電子層數是A的3倍;B原子核外電子分處3個不同能級,且每個能級上排布的電子數相同;A與C形成的最簡單分子為三角錐形;D原子p軌道上成對電子數等于未成對電子數;E原子核外每個原子軌道上的電子都已成對,E電負性小于F.| 1 |
| 8 |
| 1 |
| 2 |


湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com