
向兩燒杯中加入相同體積的1.5mol/L的稀硫酸,置于天平的左右兩托盤上,調節天平,使之達到平衡,向一個燒杯中加入5.4g鎂,另一個燒杯中加入5.4g鋁,試根據計算進行分析,當硫酸取不同體積時,反應完畢后,天平可能會發生的變化。
解析試題分析:因相同濃度、相同體積的稀硫酸,則質量相等,相同質量(wg)的鎂和鋁,則反應可能存在三種情況:
(1)若酸不足,金屬足量,則由M+H2SO4═MSO4+H2↑,酸完全反應,產生等量的氣體,則由酸的質量+金屬質量-氣體的質量═反應后燒杯中的質量,兩個反應的質量差相等,天平平衡.
(2)若酸足量,金屬均不足,則設鋅與酸反應生成的氣體為X克,鐵與酸反應生成的氣體為Y克,
5.4克鎂物質的量為5.4除以24=0.225mol 5.4克鋁物質的量為5.4除以27=0.2mol
Mg+H2SO4═ZnSO4+H2↑, 2Al+3H2SO4═Al2(SO4)3+3H2↑,
1 1 2 3
0.225 0.225 0.2 0.3
由此可知,鋁與硫酸反應放出的氣體量比較多,再由酸的質量+金屬質量-氣體的質量═反應后燒杯中的質量,與鋁反應的燒杯一端質量小,天平不平衡,有金屬鎂的燒杯一端下沉.
(3)鎂完全反應而鋁剩余時,由于酸中的氫元素,對應鎂的是完全轉化為氫氣,而鋁對應的酸中的氫元素只是部分轉化為氫氣跑掉,所以導致鋁一側沉,向鋁一側傾斜.
故答案為:
(1)若酸足量,金屬均不足,天平平衡;
(2)若酸足量,金屬均不足,有金屬鎂的燒杯一端下沉;
(3)鎂完全反應而鋁剩余時,向鋁一側傾斜
考點:考查質量守恒定律及其應用,以及化學方程式計算的相關知識點。


 陽光試卷單元測試卷系列答案
陽光試卷單元測試卷系列答案科目:高中化學 來源: 題型:填空題
(1)標準狀況下,1.92 g某氣體的體積為672 mL,則此氣體的相對分子質量為________。
(2)在25℃、101 kPa的條件下,同質量的CH4和A氣體的體積之比是15∶8,則A的摩爾質量為________。
(3)A、B兩種氣體組成的混合氣體8.6 g,在標準狀況下體積為8.96 L。已知A與B的物質的量之比為3∶1,相對分子質量之比為14∶1,由此可推斷B可能是________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的兩種或多種。取該溶液100mL,加入過量NaOH溶液,加熱,得到448mL(標況)氣體,同時產生紅褐色沉淀,經過濾、洗滌、灼燒,得到1.6g固體;將上述濾液平均分成兩份,一份中加足量BaCl2溶液,得到2.33g不溶于鹽酸的沉淀;另一份中通入過量CO2得到1.56g白色沉淀。由此可推斷原溶液一定含有的離子種類及其濃度,將結果填入下表(可不填滿)。
| 一定含有的離子種類 | | | | | | | |
| 物質的量濃度(mol/L) | | | | | | | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
當三份銅粉分別與過量的稀硝酸、濃硝酸、熱的濃硫酸充分反應后,收集到的氣體在相同狀況下體積相等時(不考慮NO2轉化為N2O4 、生成氣體溶解及產生水蒸氣的體積),其三份銅的質量比為
(2)1.28克銅與適量的濃硝酸反應,銅完全溶解,共收集到672 ml NO、NO2混合氣(標準狀況),則反應中共消耗HNO3的物質的量為
(3)用20ml 18.4 mol/L濃硫酸和銅共熱一段時間后,冷卻、過濾,將濾液稀釋到100ml,測得溶液中SO42— 的濃度為3.18mol/L,則該溶液CuSO4的物質的量濃度為
(4)Na2SiO3可以改寫成氧化物的形式為Na2O·SiO2,則質量分數為98%的濃硫酸改寫成氧化物的形式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
寫出下列物質的電子式,有結構式的請寫出結構式
①氨氣 、 ②氯化銨 、
③干冰 、 ④苛性鈉 、
⑤冰 、 ⑥過氧化鈉 、
⑦雙氧水 、 ⑧HClO 、
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
下表是用沉淀法測定KHCO3和Na2CO3混合物的組成的相關數據。實驗過程是每次稱取一定質量的樣品溶于水制成溶液,向其中滴加相同濃度的Ba(OH)2溶液,每次實驗均充分反應。實驗記錄見下表:
| 實驗次數 | 稱取樣品的 質量/g | 所加Ba(OH)2 溶液的體積/L | 測得生成沉淀 的質量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
二氧化硫和氮氧化物(NOx)是大氣的主要污染物,治理環境污染是當前環保工作的重要研究內容之一。
完成下列計算:
(1)石灰石-石膏濕法煙氣脫硫工藝技術的原理是:煙氣中的二氧化硫與漿液中的碳酸鈣以及空氣反應生成石膏(CaSO4·2H2O)。某電廠用煤300t(煤中含硫的質量分數為2.5%),若燃燒時煤中的硫全部轉化為二氧化硫,用該方法脫硫時有96%的硫轉化為石膏,則理論上可得到_________噸石膏。
(2)用CH4催化還原NOx,主要產物為N2與CO2。現有1 L NOx(含NO2、NO),用CH4將其還原成N2,消耗同溫同壓下的CH4 0.4 L,則混合氣體中NO2、NO的物質量之比為____。
(3)乙二酸(H2C2O4)的制備有如下反應:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
上述反應產生的NOx用氧氣和水吸收后生成硝酸循環利用,若尾氣NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收轉化率為90%。每生產9 kg乙二酸至少需要補充質量分數為63%的硝酸溶液多少千克?
(4)用堿液吸收法處理某工業尾氣(含NOx:NO、NO2和N2O4)的反應為:
2NO2 + 2NaOH→ NaNO2 + NaNO3 + H2O;
NO + NO2 + 2NaOH→ 2NaNO2 + H2O。
當N2O4體積分數為0.2時,處理1mol該NOx,計算生成NaNO3和NaNO2的物質的量(x可作為已知條件使用)。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
黃銅礦的主要成分X是由Cu、Fe、S三種元素組成的復鹽,其中Cu、Fe兩種元素的質量比為8:7;將m g X粉末全部溶于200 mL的濃HNO3,反應后的溶液加水稀釋至2.12 L時測得其pH為0;將稀釋后的溶液分為兩等份,向其中一份溶液中滴加6.05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/L Ba(NO3)2溶液,兩溶液中均生成沉淀,且沉淀的質量隨所加溶液的體積變化如下圖所示: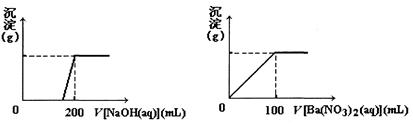
(1)請通過計算確定m的值;
(2)X的摩爾質量為368 g/mol,請確定X的化學式。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
有一硫酸與硝酸的混合溶液,取出10mL加入足量BaCl2溶液,過濾、洗滌、烘干后得到9.32g的沉淀;濾液與4.0mol·L-1NaOH溶液反應,用去35mL堿液時恰好完全中和。試求:混合液中H2SO4、HNO3的物質的量濃度各是多少?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com