
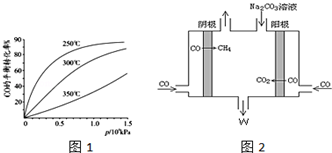
分析 (1)利用蓋斯定律計算反應熱,得到平衡狀態(tài)時,正逆反應速率相等,各物質的濃度不變,由此衍生的一些物理量也不變;
(2)①圖象分析可知壓強一定,溫度升高CO轉化率減小,說明升溫平衡逆向進行,逆向是吸熱反應,溫度在250°一氧化碳轉化率高,反應速率大;
②由此電解原理可知,陽極失去電子生成二氧化碳氣體,加入碳酸鈉,碳酸鈉與二氧化碳反應生成碳酸氫鈉,陰極CO得到電子生成甲烷氣體.
解答 解:(1)①NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-56.5kJ•mol-1
②2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1
將方程式(②-①×2)×$\frac{1}{2}$得:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ/mol,
a.隨反應:NO2(g)+SO2(g)?SO3(g)+NO(g)的進行,氣體的質量和物質的量都不變,混合氣體的平均相對分子質量始終不變,不能說明到達平衡狀態(tài),故a錯誤;
b.混合氣體顏色保持不變,說明二氧化氮的濃度不變,說明到達平衡狀態(tài),故b正確;
c.隨反應進行,SO3和NO都是生成物,所以體積比一直等于系數(shù)比,所以SO3和NO的體積比保持不變,不能說明到達平衡狀態(tài),故c錯誤;
d.每生成1molSO3的同時消耗1molNO2都表示逆反應速率,反應自始至終都按此比例進行,故d錯誤;
故答案為:-41.8;b;
(2)①圖象分析可知壓強一定,溫度升高CO轉化率減小,說明升溫平衡逆向進行,逆向是吸熱反應,正向為放熱反應,△H<0,圖象分析可知,溫度在250°一氧化碳轉化率高,反應速率大,
故答案為:<;250;
②由此電解原理可知,陽極失去電子生成二氧化碳氣體,加入碳酸鈉,碳酸鈉與二氧化碳反應生成碳酸氫鈉,陰極CO得到電子生成甲烷氣體,據(jù)此離子反應方程式為:4CO+3CO32-+5H2O=6HCO3-+CH4↑,陰極區(qū)電極反應式為:CO+6e-+5H2O=6OH-+CH4,
故答案為:CO+6e-+5H2O=6OH-+CH4.
點評 本題考查較為綜合,為高考常見題型,側重于學生的分析能力、計算能力的考查,題目涉及熱化學方程式書寫,化學平衡影響因素分析判斷,原電池原理和電極反應書寫方法,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在陰離子中,質子數(shù)一定少于核外電子數(shù) | |
| B. | 氧化反應就是物質與氧氣發(fā)生的反應 | |
| C. | 在化學反應中加入催化劑一定能加快反應的速率 | |
| D. | 最外層電子數(shù)為8的粒子一定是稀有氣體元素的原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
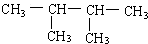 系統(tǒng)命名:2,3-二甲基丁烷
系統(tǒng)命名:2,3-二甲基丁烷
 的分子式:C4H8O
的分子式:C4H8O查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S(s)+O2(g)═SO2(g),反應放出的熱量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g),反應放出的熱量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2的鍵能總和大于1 mol硫和1 mol氧氣的鍵能之和 | |
| D. | 1 mol SO2的鍵能總和小于1 mol硫和1 mol氧氣的鍵能之和 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
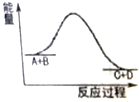
| A. | 該反應為吸熱反應 | |
| B. | 該反應只有在加熱的條件下才能進行 | |
| C. | 反應物的總能量高于生成物的總能量 | |
| D. | 反應物中的化學鍵斷裂要放出熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用鹽酸酸化的BaCl2溶液來判斷亞硫酸鈉固體是否發(fā)生變質 | |
| B. | 加入硝酸銀溶液看是否產生白色沉淀來判斷溶液中是否有氯離子 | |
| C. | 可加入足量的銅粉然后過濾來除去氯化亞鐵溶液中的少量氯化鐵 | |
| D. | 加入澄清石灰水看是否有白色沉淀來區(qū)別碳酸鈉溶液和碳酸氫鈉溶液 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com