
| A. | 該反應中的還原劑是 S2O32- | |
| B. | 根據該反應可判斷氧化性:Cl2>SO42- | |
| C. | 上述反應中,每生成 1 mol SO42-,可脫去2molCl2 | |
| D. | 該反應的氧化產物是 Cl- |
分析 反應的離子方程式為S2O32-+4Cl2+10OH-=2SO42-+8Cl-+5H2O,從化合價變化的角度分析氧化還原反應.
解答 解:反應的離子方程式為S2O32-+4Cl2+10OH-=2SO42-+8Cl-+5H2O,則
A.反應中S元素的化合價升高,被氧化,則S2O32-為還原劑,故A正確;
B.氧化劑氧化性大于氧化產物的氧化性,反應中氧化性:Cl2>SO42-,故B正確;
C.由反應的方程式可知,每生成lmolSO42-,可脫去2molCl2,故C正確;
D.氯氣是氧化劑,所以氯離子是還原產物,故D錯誤.
故選D.
點評 本題考查氧化還原反應,題目難度中等,解答該題的關鍵是能夠寫出反應的離子方程式.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
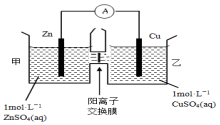
| A. | 銅電極上發生還原反應 | |
| B. | 電池工作一段時間后,甲池的c(SO42-)不變 | |
| C. | 電池工作一段時間后,乙池溶液的總質量增加 | |
| D. | 陰陽離子離子分別通過交換膜向負極和正極移動,保持溶液中電荷平衡 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有金屬的化合物灼燒時才會有不同的顏色 | |
| B. | 每次實驗后,鉑絲都要用水洗凈 | |
| C. | 若透過藍色鈷玻璃只看到紫色,說明樣品中含鉀元素而一定不含鈉元素 | |
| D. | 若樣品灼燒呈黃色,判斷一定有鈉元素,但不能排除含其他金屬元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向Fe(NO3)2稀溶液中加入鹽酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 鋁和氫氧化鈉水溶液反應:Al+2OH-+2H2O═AlO2-+3H2↑ | |
| C. | 碳酸氫銨溶液與足量的NaOH溶液混合后加熱:NH4++OH- $\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl2在①、③反應中是氧化劑 | |
| B. | 氧化性強弱的順序為:BrO3->ClO3->Cl2>Fe3+ | |
| C. | 溶液中可發生:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O | |
| D. | Cl2是ClO3- 的還原產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 凡含離子鍵的化合物,一定含金屬元素 | |
| B. | 在化合物MgCl2中,兩個氯離子之間也存在離子鍵 | |
| C. | 離子化合物一定能導電 | |
| D. | 原子序數為11與9的元素能夠形成離子化合物,該化合物中存在離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用試管取出試劑瓶中的Na2CO3溶液,發現取量過多,為了不浪費,又把過量的試劑倒入試劑瓶中 | |
| B. | 粗鹽提純時,為了加快過濾速率.可以用玻璃棒進行攪拌 | |
| C. | 用蒸發方法使NaCl從溶液中析出時,應將蒸發皿中NaCl溶液全部加熱蒸干 | |
| D. | 用濃硫酸配制一定物質的最濃度的稀硫酸時,濃硫酸溶于水后,應冷卻至室溫才能轉移到容量瓶中 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com