
【題目】(1)1mol H2SO4中含______mol氧原子,________個氫原子。
(2)4.5g水與________g硫酸所含的分子數相等,它們所含氧原子數之比是________。
【答案】42NA(或1.204×1024)24.51:4
【解析】
(1)1個H2SO4分子中含4個O原子、2個H原子,1molH2SO4中含4mol氧原子;含2mol氫原子,H原子數為2NA或2mol![]() 6.02
6.02![]() 1023mol-1=1.204
1023mol-1=1.204![]() 1024個。
1024個。
(2)4.5gH2O的物質的量為4.5g![]() 18g/mol=0.25mol,與4.5gH2O所含分子數相等的H2SO4物質的量為0.25mol,質量為0.25mol
18g/mol=0.25mol,與4.5gH2O所含分子數相等的H2SO4物質的量為0.25mol,質量為0.25mol![]() 98g/mol=24.5g;0.25molH2O中含氧原子物質的量為0.25mol,0.25molH2SO4中含氧原子物質的量為0.25mol
98g/mol=24.5g;0.25molH2O中含氧原子物質的量為0.25mol,0.25molH2SO4中含氧原子物質的量為0.25mol![]() 4=1mol,所含氧原子數之比為1:4。
4=1mol,所含氧原子數之比為1:4。


 全能測控一本好卷系列答案
全能測控一本好卷系列答案科目:高中化學 來源: 題型:
【題目】X、Y、Z、W均為短周期元素,它們在元素周期表中的位置如下圖所示。若Y原子的最外層電子數是次外層電子數的3倍,下列說法中不正確的是

A. 離子半徑:Z>X>Y
B. 最高價氧化物對應水化物的酸性:Z>W>X
C. Y、Z位于元素周期表中第ⅥA族,但最高正價不相同
D. X、W的氣態氫化物混合產生白煙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如表為元素周期表的一部分,標出了A~K共十種元素所在位置。請用元素符號或化學式回答下列問題。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | A | B | ||||||
3 | C | D | E | F | G | |||
4 | H | I | K |
(1)10種元素中,化學性質最不活潑的是______,最活潑的金屬是_____。
(2)C、E、F三種元素形成的簡單離子半徑最小的是_______。
(3)化合物C2B2的電子式為__________________;該化合物和AB2反應的化學方程式為__________________________________________。
(5)D的單質在A、B形成化合物中燃燒的化學方程式為________________________。
(6)用電子式表示H與B組成的H2B型化合物的形成過程_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,下列敘述正確的是
A. 若V1LpH=11的NaOH溶液與V2LpH=3的HA溶液混合后顯中性,則V1≤V2
B. 等體積、等物質的量濃度的NaCl溶液中離子總數大于NaClO溶液中離子總數
C. 等體積、等物質的量濃度的Na2CO3和NaHCO3溶液混合:![]() <
<![]()
D. 將CH3COOH溶液與NaOH溶液混合,若混合后的溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),且溶液顯酸性,則c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重鉻酸鉀是一種重要的化工原料,某科研小組采用如下方案由鉻鐵礦(主要成分為FeO·Cr2O3,還含有SiO2、Al2O3 等雜質)制備重鉻酸鉀。
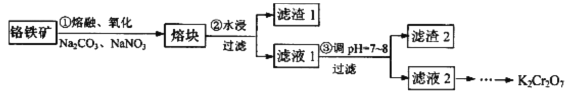
己知:①鉻鐵礦在熔融、氧化過程中發生的主要反應:
FeO·Cr2O3+Na2CO3+ NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CO3+Al2O3![]() NaA1O2+CO2↑
NaA1O2+CO2↑
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
③有關物質的溶解度如圖所示。

(1)步驟①中反應物NaNO3的作用是_______,熔融時所用的儀器為________(填字母)。
A瓷坩堝 B.鐵坩堝 C.氧化鋁坩堝
(2)步驟②所得的濾渣1中含量最多的金屬元素是___________。
(3)步驟③可用醋酸調節濾液1的pH至7~8,可用__________(填儀器或用品名稱)測定溶液的pH,寫出步驟③加醋酸生成Al(OH)3 的離子方程式____________________________________。
(4)請設計從濾液2(主要溶質為Na2CrO4)制取K2Cr2O7固體的實驗方案:__________(實驗中須使用的試劑有: KC1固體、1mol/L硫酸溶液)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體A在一定條件下可完全分解,生成B、C、D三種氣體的混合物。反應方程式如下:2A=B↑+2C↑+3D↑,此時測得混合氣體的相對平均分子質量為26,則固體A的摩爾質量為( )
A. 30g/mol B. 90g/mol C. 78g/mol D. 90
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com