
堿式碳酸鐵的組成可表示為xFe2(CO3)3·yFe(OH)3·zH2O。某化學興趣小組完成以下實驗目的:
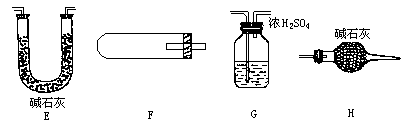
(1)探究堿式碳酸鐵完全分解后的殘留固體是否可使乙醇(已知乙醇的沸點為78 ℃)發生去氫氧化,并檢驗反應產物。如圖已裝配好一套裝置,回答下列問題:

①該裝置用于進行實驗需加熱的儀器有(選填序號字母)________;
②若在試管A中觀察粉末由紅色變成黑色,試管D銀氨溶液中觀察到試管壁內產生銀鏡,可以得出的結論是_________________________________________;寫出A中發生的化學方程式_____________________________________;
③為確保反應物有較高的利用率,且使裝置中氣流平穩,應對C部分進行的改進_____________________________________。
(2)請從上圖中選擇適當的裝置采用氫氣還原法測定堿式碳酸鐵組成:
①如何檢驗E裝置的氣密性?___________________________________________;
②該興趣小組的同學設計的實驗裝置連接順序為:E→G→G→I→G→F→H,則:第1、3次使用G裝置的作用分別是______________________,___________________________;H裝置的作用是__________________________________。
科目:高中化學 來源:江蘇省常州市橫山橋高級中學2011屆高三第一次調研考試化學試題 題型:058
銅器銹蝕的結果會生成銅綠(堿式碳酸銅),孔雀石和石青是自然界存在的兩種碳酸鹽類銅礦.
(1)在潮濕的空氣中,銅與空氣中的二氧化碳、水和氧氣等共同作用發生吸氧腐蝕,生成堿式碳酸銅,有關反應的電極方程式為:________.
(2)某種堿式碳酸銅的組成可表示為Cu2(OH)2CO3·xH2O,在加熱條件下,發生分解的化學方程式為:Cu2(OH)2CO3·xH2O![]() 2CuO+CO2↑+(x+1)H2O.現取該堿式碳酸銅樣品,進行測量該樣品(粉末)組成中碳的質量分數和結晶水x的值的實驗.
2CuO+CO2↑+(x+1)H2O.現取該堿式碳酸銅樣品,進行測量該樣品(粉末)組成中碳的質量分數和結晶水x的值的實驗.
現有下面幾種儀器(必要的鐵架臺、鐵夾、酒精燈、橡皮管等,均在圖中略去)

用上述儀器進行組裝并做實驗時,按氣流方向從左到右連接順序是(用字母填寫,下同)( )→( )→( )→(D)
(3)
孔雀石和石青的化學組成可表示為:xCuCO3·yCu(OH)2(x、y為正整數且x≤2,y≤2).孔雀石和石青分別與過量鹽酸反應時,孔雀石耗用的鹽酸的物質的量與生成的CO2的物質的量之比為4∶1;石青則為3∶1,請推算它們的化學組成.孔雀石:________;石青:________.
查看答案和解析>>
科目:高中化學 來源:考必通高考復習經典設計 題型:058
某種堿式碳酸銅其組成可表示為 ,在加熱的條件下,反應為
,在加熱的條件下,反應為
 2CuO+
2CuO+ ↑+(x+1)
↑+(x+1) ,某同學粗略取一定樣品,先后進行兩個實驗:實驗(Ⅰ):測定
,某同學粗略取一定樣品,先后進行兩個實驗:實驗(Ⅰ):測定 中x的值.實驗
中x的值.實驗
(Ⅱ)用實驗(Ⅰ)中所得固體與氫氣反應.
(1)現已裝置好如下圖所示的實驗裝置甲、乙,裝置中一些附加設置均已略去,其中________是用來完成上述實驗________的(填標號).為安全起見,本實驗開始后應在你選用的裝置的B處________.

(2)用下圖中的儀器(必要的鐵架臺、鐵夾、酒精燈均在圖中略去)組裝一個實驗裝置,完成另一個實驗.組裝時,儀器按氣流方向從左到右連接順序為________→________→________→________,這套裝置中,H的作用是什么________.
(3)為測定和計算堿式碳酸銅粉末中的x值,某個細心的同學在實驗前后準確稱量了一些儀器的質量(連同所盛試劑)分別記為 (F裝置連同藥品反應前后的質量差,取正值,下同)、
(F裝置連同藥品反應前后的質量差,取正值,下同)、 ,為求x,這幾個數據可用的是________,它們的組合有________種.
,為求x,這幾個數據可用的是________,它們的組合有________種.
查看答案和解析>>
科目:高中化學 來源:101網校同步練習 高二化學 山東科學技術出版社 魯教版 題型:058
銅是生命必須的元素,也是人類最早使用的金屬之一.銅的生產和使用對國計民生的各個方面產生了深遠的影響(在化學反應中,銅元素通常可表現為0+1+2價).
(1)在西漢古籍中曾有記載:曾青得鐵則化為銅[即:曾青(CuSO4)跟鐵反應就生成Cu].試寫出該反應的離子方程式________.
(2)銅器表面有時會生成銅綠[Cu2(OH)2CO3],這層銅綠可用化學方法除去.試寫出除去銅綠而不損傷器物的反應的化學方程式________.
(3)某種堿式碳酸銅的組成可表示為Cu2(OH)2CO3·xH2O,在加熱條件下,發生分解的化學方程式為:Cu2(OH)2CO3·xH2O=2CuO+CO2↑+(x+1)H2O.現取該堿式碳酸銅樣品,進行測量該樣品組成中碳的質量分數和結晶水x值的實驗.
現有如圖所示幾種儀器(必要的鐵架臺.鐵夾、酒精燈、橡皮管等,均在圖中略去):

用上述儀器進行組裝并作實驗,按氣流方向從左到右的連接順序是(用字母填寫下同)( )→( )→( )→(D).
(4)新制的Cu(OH)2懸濁液與葡萄糖反應會生成紅色沉淀.因此該試劑可用于檢測糖尿病患者尿液中葡萄糖的含量.葡萄糖的結構簡式如下:
CH2OH-CHOH-CHOH-CHOH-CHOH-CHO(簡寫為GCHO)
試寫出GCHO與新制Cu(OH)2懸濁液反應的化學方程式________.
查看答案和解析>>
科目:高中化學 來源:2012-2013學年廣東省韶關市高三第二次模擬考試理綜化學試卷(解析版) 題型:實驗題
堿式碳酸銅是一種用途廣泛的化工原料。工業上可用酸性刻蝕廢液(主要含有Cu2+、Fe2+、Fe3+、H +、Cl-)制備,其制備過程如下:

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
|
物 質 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
|
開始沉淀pH |
4.2 |
5.8 |
1.2 |
|
完全沉淀pH |
6.7 |
8.3 |
3.2 |
(1)濾渣的主要成分是 (寫化學式)。
(2)調節反應A后溶液的pH范圍應為 。選擇的試劑最合適的是 (填序號)。
a.氨水 b.稀硫酸 c.氫氧化鈉 d.碳酸銅
(3)反應B的溫度如過高,則所得藍綠色產品中可能會出現的雜質是 。
(4)將Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。用相應的離子方程式表示:
① 沉淀只有CuCO3: ;
② 沉淀只有Cu(OH)2 且放出氣泡: 。
(5)堿式碳酸銅的組成可表示為:aCuCO3•bCu(OH)2•cH2O。要測定其組成,甲同學設計的實驗方案中需要如下五個步驟:①稱量樣品的質量;②高溫分解;③測出CO2的質量;④測出水蒸汽的質量;⑤稱量CuO的質量。而乙同學認為除步驟②外,實驗只需測定四個量中的三個即可,則合理的組合為 (填序號,寫一組即可)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com