
【題目】硫和釩的相關化合物,在藥物化學及催化化學等領域應用廣泛。回答下列問題:
(1)基態釩原子的外圍電子軌道表達式為___________,釩有+2、+3、+4、+5等多種化合價,其中最穩定的化合價是________,VO43-的幾何構型為________.
(2)2-巰基煙酸氧釩配合物(圖1) 是副作用小的有效調節血糖的新型藥物。
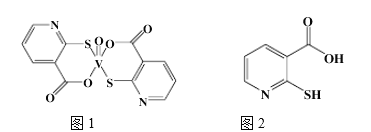
①基態S原子中原子核外未成對電子數為_______,該藥物中S原子的雜化方式是_______.所含第二周期元素第一電離能按由大到小順序的排列是___________.
②2-巰基煙酸(圖2) 水溶性優于2-巰基煙酸氧釩配合物的原因是_________.
(3)多原子分子中各原子若在同一平面,且有相互平行的p軌道,則p電子可在多個原子間運動,形成“離域Π鍵”,下列物質中存在“離域Π鍵”的是_____.
A.SO2 B.SO42- C.H2S D.CS2
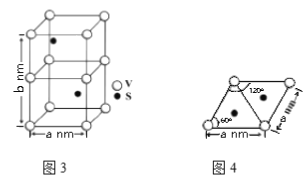
(4)某六方硫釩化合物晶體的晶胞如圖3所示,該晶胞的化學式為______。圖4 為該晶胞的俯視圖,該晶胞的密度為________g/cm3 (列出計算式即可)。
【答案】 ![]() +5 正四面體 2 sp3 N>O>C 2-巰基煙酸的羧基可與水分子之間形成氫鍵,使其在水中溶解度增大 AD VS
+5 正四面體 2 sp3 N>O>C 2-巰基煙酸的羧基可與水分子之間形成氫鍵,使其在水中溶解度增大 AD VS ![]()
【解析】(1)釩原子為23號元素,電子排布式為[Ar]3d34s2,所以外圍電子軌道排布式為![]() 。其最穩定的化合價應該是+5,即失去所有的價電子,形成最外層8電子的穩定結構。根據價層電子對互斥原理,VO43-中的中心原子V的價電子為5,配位原子O不提供電子,帶有三個單位負電,所以外層電子為8個,共4對,空間構型為正四面體。
。其最穩定的化合價應該是+5,即失去所有的價電子,形成最外層8電子的穩定結構。根據價層電子對互斥原理,VO43-中的中心原子V的價電子為5,配位原子O不提供電子,帶有三個單位負電,所以外層電子為8個,共4對,空間構型為正四面體。
(2)①S原子的電子排布為[Ne]3s23p4,所以S原子的3p能級上有4個電子,分配在三個軌道中,有兩個單電子。從圖中得到S的配位數為2,所以此時S的外層有6+2=8個電子,電子對為4,所以S應該的雜化方式是sp3雜化。其中含有的第二周期元素是C、N、O。同周期元素從左向右應該是第一電離能增大,因為N的2p能級上有3個電子,是p能級的半滿穩定結構,所以N的第一電離能反常增大,所以第一電離能為:N>O>C。
②2-巰基煙酸有羧基可以與水分子形成氫鍵,所以其水溶性會更好。
(3)從題目表述來看,形成離域Π鍵的要求是:①原子共平面;②有相互平行的p軌道。根據價層電子對互斥理論,二氧化硫為平面三角形,硫酸根為正四面體,硫化氫為角型,二硫化碳為直線型。所以選項B一定錯誤。而硫化氫的H原子不存在p軌道。所以選項C錯誤。由上正確的是選項A和選項D。
(4)晶胞中有V為:8×1/8+4×1/4=2個;S為:2×1=2個,所以化學式為VS。因為該晶胞中有2個VS,所以晶胞質量為2×(32+51)/NA g。根據圖4得到晶胞底面的面積為a×![]() nm2,所以晶胞的體積為:a×
nm2,所以晶胞的體積為:a×![]() ×b nm3。1nm=10-7cm,所以晶體密度為
×b nm3。1nm=10-7cm,所以晶體密度為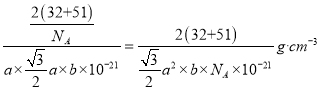 。
。


 寒假樂園北京教育出版社系列答案
寒假樂園北京教育出版社系列答案科目:高中化學 來源: 題型:
【題目】下圖為某有機化合物的結構簡式:
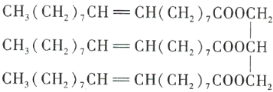
請回答下列問題。
(1)該有機化合物含有的官能團有_______________(填名稱)。
(2)該有機化合物的類別是_______________(填字母序號,下同)。
A.烯烴 B.酯 C.油脂 D.羧酸
(3)將該有機化合物加入水中,則該有機化合物_______________。
A.與水互溶 B.不溶于水,水在上層 C.不溶于水,水在下層
(4)該物質是否有固定熔點、沸點?_______________(填“是”或“否”)
(5)能與該有機化合物反應的物質有_______________。
A.![]() 溶液 B.碘水 C.乙醇 D.乙酸 E.
溶液 B.碘水 C.乙醇 D.乙酸 E.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳是地球上組成生命的最基本的元素之一。按要求回答:
![]() 碳原子核外有________種不同空間運動狀態的電子
碳原子核外有________種不同空間運動狀態的電子
![]() 碳元素能形成多種無機物。石墨與鉀可形成石墨夾層離子晶體
碳元素能形成多種無機物。石墨與鉀可形成石墨夾層離子晶體![]() 如圖
如圖![]() ,其結構為每隔一層碳原子插入一層鉀原子,與鉀原子層相鄰的上下兩層碳原子排列方式相同,則與鉀最近等距的配位碳原子有_________個。
,其結構為每隔一層碳原子插入一層鉀原子,與鉀原子層相鄰的上下兩層碳原子排列方式相同,則與鉀最近等距的配位碳原子有_________個。
![]() 碳也可形成多種有機化合物,下圖所示是一種嘌呤和一種吡啶的結構,兩種分子中所有原子都在一個平面上。
碳也可形成多種有機化合物,下圖所示是一種嘌呤和一種吡啶的結構,兩種分子中所有原子都在一個平面上。![]() 吡啶分子中含有
吡啶分子中含有![]() 鍵數目是__________。
鍵數目是__________。
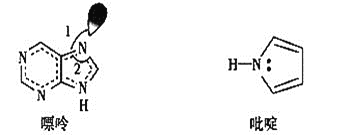
![]() 嘌呤結構中N原子的雜化方式為________。
嘌呤結構中N原子的雜化方式為________。
![]() 嘌呤中軌道之間的夾角
嘌呤中軌道之間的夾角![]() 比
比![]() 大,解釋原因___________。
大,解釋原因___________。
![]() 將立方金剛石中的每個碳原子用一個由4個碳原子組成的正四面體結構單元取代可形成碳的一種新型三維立方晶體結構
將立方金剛石中的每個碳原子用一個由4個碳原子組成的正四面體結構單元取代可形成碳的一種新型三維立方晶體結構![]() 碳。已知
碳。已知![]() 碳密度為
碳密度為![]() ,阿伏加德羅常數為
,阿伏加德羅常數為![]() ,則
,則![]() 碳的晶胞參數
碳的晶胞參數![]() ________
________![]() 寫出表達式即可
寫出表達式即可![]() 。
。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵、鈷、鎳具有相似的性質,在化學上稱為鐵系元素。回答下列問題:
![]() 、
、![]() 常用作鋰離子電池的正極材料。
常用作鋰離子電池的正極材料。![]() 的空間構型為____________基態Co原子核外電子排布式為____________,第四電離能
的空間構型為____________基態Co原子核外電子排布式為____________,第四電離能![]() ______
______![]() 填“
填“![]() ”或
”或![]() ”
”![]() ,原因是________________。
,原因是________________。
![]() 鐵系元素能與CO形成
鐵系元素能與CO形成![]() 、
、![]() 等金屬羰基配合物。
等金屬羰基配合物。![]() 中與Fe形成配位鍵的是______
中與Fe形成配位鍵的是______![]() 填“碳”或“氧”
填“碳”或“氧”![]() 原子。與CO互為等電子體的是_________
原子。與CO互為等電子體的是_________![]() 任寫一種即可
任寫一種即可![]() 。在CO分子中,
。在CO分子中,![]() 鍵與
鍵與![]() 鍵數目之比為________。
鍵數目之比為________。
![]() 鐵與
鐵與![]() 、
、![]()
![]() 環戊二烯
環戊二烯![]() 在隔絕空氣條件下共熱可制得二茂鐵
在隔絕空氣條件下共熱可制得二茂鐵![]() 。在環戊二烯中,C原子的雜化軌道類型為______。二茂鐵熔點為446K,不溶于水,易溶于乙醚、苯、乙醇等有機溶劑,373K即升華,則它的晶體類型是___________。
。在環戊二烯中,C原子的雜化軌道類型為______。二茂鐵熔點為446K,不溶于水,易溶于乙醚、苯、乙醇等有機溶劑,373K即升華,則它的晶體類型是___________。
![]() 鐵單質的堆積方式有兩種,其中一種剖面圖如圖所示:
鐵單質的堆積方式有兩種,其中一種剖面圖如圖所示:
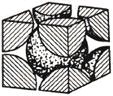
在此堆積方式里,鐵原子的半徑為![]() ,則其晶胞棱長為_______________cm。
,則其晶胞棱長為_______________cm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cu及化合物在生產、國防中有重要的應用。
I.納米級Cu2O既是航母艦艇底部的防腐蝕涂料,也是優良的催化劑。
(1)已知:Cu2O(s)+![]() O2(g)=2CuO(s) ΔH=-196kJ·mol-1
O2(g)=2CuO(s) ΔH=-196kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220.8kJ·mol-1
則工業上用碳粉與CuO粉末混合在一定條件下反應制取Cu2O(s),同時生成CO氣體的熱化學方程式為___。
(2)用納米級Cu2O作催化劑可實現甲醇脫氫制取甲醛:CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如圖所示。
HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如圖所示。
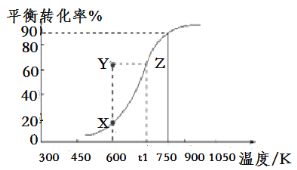
①該反應的ΔH___0(填“>”或“<”);600K時,Y點甲醇的v(正)___v(逆)(填“>”或“<”)。
②在t1K時,向固定體積為1L的密閉容器中充入2molCH3OH(g),溫度保持不變,9分鐘時達到平衡,則0~9min內用CH3OH(g)表示的反應速率v(CH3OH)___,溫度為t1時,該反應的平衡常數K的表達式為___。
II.Cu既是常見的催化劑,又是常見的電極材料。
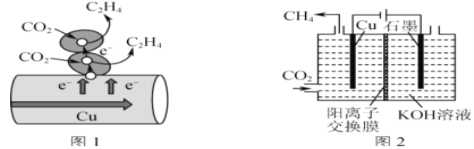
(3)圖1表示的是利用CO2的“直接電子傳遞機理”。在催化劑銅的表面進行轉化。當直接傳遞的電子物質的量為2mol時,則參加反應的CO2的物質的量為___。
(4)圖2表示以KOH溶液作電解質溶液進行電解的示意圖,CO2在Cu電極上可以轉化為CH4,該電極反應的方程式為___。
III.含銅離子的廢水會造成污染,通常將其轉化為硫化銅沉淀而除去。
(5)已知:Ksp(CuS)=1×10-36,要使銅離子的濃度符合排放標準(不超過6.25×10-6mol/L),溶液中的硫離子的物質的量濃度至少為___mol/L(保留至小數點后一位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知硫代硫酸鈉在酸性條件下會發生反應:![]() ,下表中的兩種溶液混合,出現渾濁的先后順序是( )
,下表中的兩種溶液混合,出現渾濁的先后順序是( )
組號 | 兩種溶液的溫度 |
| 稀硫酸的體積、濃度 |
① | 15℃ | 10mL0.1mol/L | 50mL0.05mol/L |
② | 15℃ | 10mL0.05mol/L | 10mL0.1mol/L |
③ | 25℃ | 10mL0.05mol/L | 10mL0.1mol/L |
④ | 25℃ | 10mL0.1mol/L | 30mL0.07mol/L |
A.④①②③B.③④②①
C.④③②①D.④③①②
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
A. 中子數為18的氯原子:![]()
B. N2的結構式:N=N
C. Na+的結構示意圖: 
D. H2O的電子式: ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國航天航空事業蒸蒸日上,航天航空的關鍵技術是火箭,火箭燃料有液氫、乙炔![]() 、甲烷、煤油、肼
、甲烷、煤油、肼![]() 等。請回答下列問題:
等。請回答下列問題:
(1)已知肼的結構簡式可表示為![]() 。
。
①肼分子中的化學鍵類型為 _______________________。
②肼在氧氣中燃燒生成無毒的物質,則反應中肼斷裂的化學鍵有N—H鍵、_______________________,新形成的化學鍵有_______________________ 。
③根據肼燃燒過程中的能量變化,說明反應物能量之和_______________________ (填“大于”“等于”或“小于”)生成物能量之和。
(2)氫燃料汽車中氫的燃燒與火箭中氫的燃燒最大的不同在于前者使用的是空氣作氧化劑,而后者使用的是液氧。火箭中不能使用液化空氣,原因是_______________________ 。
(3)火箭發射前,當液氫、液氧加到一定量后,技術人員還要不停地補加,請你說出這種做法的原因_______________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫、恒壓條件下,1 mol A和1 mol B在一個容積可變的容器中發生反應![]() ,一段時間后達到平衡狀態,生成amol C。下列說法不正確的是( )
,一段時間后達到平衡狀態,生成amol C。下列說法不正確的是( )
A.起始時和達到平衡狀態時容器中的壓強比為1:1
B.物質A、B的轉化率之比一定是1:2
C.達到平衡狀態時A的物質的量為![]()
D.當![]() 時,可斷定反應達到平衡狀態
時,可斷定反應達到平衡狀態
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com