
下列各組順序的排列錯誤的是
A.半徑:F—>Na+>Mg2+>Al3+ B.沸點:H2O< H2S < H2Se
C.酸性:HClO4>H2SO4>H3PO4 D.熔點:SiO2>NaCl>CO2
 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源:2015-2016學年黑龍江大慶鐵人中學高二上9月考化學試卷(解析版) 題型:選擇題
已知在25℃,101kPa下,l g C8H18(辛烷)燃燒生成二氧化碳和液態水時放出48.40kJ熱量。表示上述反應的熱化學方程式正確的是
A.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g); △H=-48.40kJ·mol-1
B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省貴陽市高三8月摸底考試化學試卷(解析版) 題型:填空題
(6分)化合物A是天然蛋白質水解的最終產物,其相對分子質量為165,其中O元素的質量分數小于20%,N元素的質量分數小于10%。
請回答下列問題:
(1)A的分子式為 ;
(2)光譜測定顯示,A分子結構中含有苯環且不存在甲基(一C H3),則A的結構簡式為 ;
(3)寫出A發生縮聚反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年安徽省合肥市高二上開學考試化學試卷(解析版) 題型:實驗題
(14分)某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響.在常溫下按照如下方案完成實驗.
分組實驗 | 催化劑 | |
① | 10mL 5% H2O2溶液 | 無 |
② | 10mL 2% H2O2溶液 | 無 |
③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
(1)寫出實驗③中H2O2分解反應方程式并標明電子轉移的方向和數目: .
(2)實驗①和②的目的是 .
實驗時由于沒有觀察到明顯現象而無法得出結論.資料顯示,通常條件下H2O2穩定,不易分解.為了達到實驗目的,你對原實驗方案的改進是 .
(3)實驗③、④、⑤中,測得生成氧氣的體積隨時間變化的關系如圖1.分析上圖能夠得出的實驗結論: 環境能增大H2O2分解的速率; 環境能減小H2O2分解速率.
(4)將0.1g MnO2粉末加入50mL H2O2溶液中,在標準狀況下放出氣體的體積和時間的關系如圖2所示.解釋反應速率變化的原因: ,計算H2O2的初始物質的量濃度為 .(保留兩位有效數字,在標準狀況下測定)

查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三普通班8月月考化學試卷(解析版) 題型:選擇題
某同學設計如下圖所示裝置,探究氯堿工業原理,下列說法正確的是
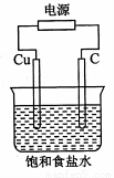
A.石墨電極與直流電源負極相連
B.用濕潤KI淀粉試劑在銅電極附近檢驗氣體,試紙變藍色
C.氫氧化鈉在石墨電極附近產生, Na+向石墨電極遷移
D.銅電極的反應式為:2H+ + 2e-= H2↑
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三9月調考化學試卷(解析版) 題型:選擇題
下列說法錯誤的是
A.向0.1 mol/L的CH3COOH溶液中加入少量CH3COONH4固體,溶液的pH增大
B.室溫下,pH=4的NaHSO4溶液中,水電離出的H+濃度為1×10-10 mol/L
C.濃度均為0.1 mol/L的HCN溶液和NaCN溶液等體積混合(忽略體積變化),溶液中c(HCN)+c(CN-)=0.1 mol/L
D.pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三種溶液的c(NH4+):②<③<①
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省高三上學期開學考試化學試卷(解析版) 題型:填空題
對碳及其氧化物的化學熱力學、動力學研究有助于人類充分利用化石燃料,消除氧化物對環境的負面影響。
(1)25℃時,石墨和CO的燃燒熱分別為:393.5kJ/mol、283.0kJ/mol。請寫出石墨不完全燃燒時的熱化學方程式 。
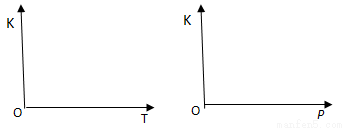
(2)25℃時,反應2CO2(g) 2CO(g)+ O2(g)的平衡常數K=2.96×10-92。在一個體積可變的密閉容器中(起始時容器體積為1L)充入一定量CO2、CO、O2的混合氣體,要使容器中的反應開始時向CO2分解的方向進行,起始時三種氣體的物質的量濃度應滿足的關系是 。當該反應在25℃時達到平衡后,其他條件不變時,升高溫度或增加容器的壓強,均能使該平衡發生移動,②請在坐標中作出該反應的平衡常數K隨溫度(T)、壓強(p)變化的示意圖。
2CO(g)+ O2(g)的平衡常數K=2.96×10-92。在一個體積可變的密閉容器中(起始時容器體積為1L)充入一定量CO2、CO、O2的混合氣體,要使容器中的反應開始時向CO2分解的方向進行,起始時三種氣體的物質的量濃度應滿足的關系是 。當該反應在25℃時達到平衡后,其他條件不變時,升高溫度或增加容器的壓強,均能使該平衡發生移動,②請在坐標中作出該反應的平衡常數K隨溫度(T)、壓強(p)變化的示意圖。
(3)1600℃時,反應2CO(g)+ O2(g) 2CO2(g)的平衡常數K=1.0×108。經測定,汽車尾氣中CO和CO2氣體的濃度分別為4.0×10-5mol/L和4.0×10-4mol/L。若在汽車的排氣管上增加一個1600℃時的補燃器,并不斷補充O2使其濃度始終保持為4.0×10-4mol/L。則經補燃處理后尾氣中CO的濃度為 mol/L(結果保留兩位有效數字)。
2CO2(g)的平衡常數K=1.0×108。經測定,汽車尾氣中CO和CO2氣體的濃度分別為4.0×10-5mol/L和4.0×10-4mol/L。若在汽車的排氣管上增加一個1600℃時的補燃器,并不斷補充O2使其濃度始終保持為4.0×10-4mol/L。則經補燃處理后尾氣中CO的濃度為 mol/L(結果保留兩位有效數字)。
(4)以CO和O2為電極燃料,以熔融K2CO3為電解質組成燃料電池,請寫出該電池的負極反應式 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com