
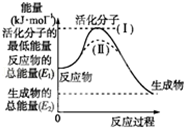
 I.請認真觀察圖,然后回答問題.
I.請認真觀察圖,然后回答問題.分析 I.(1)依據圖象分析反應物的能量大于生成物的能量,反應放熱;在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才能發生化學反應,反應需要能量;反應的焓變=生成物的能量-反應物的能量;
(2)反應的活化能是使普通分子變成活化分子所需提供的最低限度的能量,依據圖象能量關系可知,逆反應的活化能=正反應的活化能+反應的焓變;
(3)對于同一反應,圖中虛線( II)與實線( I)相比,活化能大大降低,活化分子的百分數增多,反應速率加快,說明反應的活化能降低焓變不變,平衡不動,結合影響所以速率的元素分析判斷;
II.根據反應熱△H=反應物總鍵能-生成物總鍵能計算反應熱.
解答 I解:(1)依據圖象分析反應物的能量大于生成物的能量,反應放熱;在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才能發生化學反應,反應需要能量;反應的焓變=生成物的能量-反應物的能量;△H=E2-E1;
故答案為:放熱;需要;E2-E1 ;
(2)反應的活化能是使普通分子變成活化分子所需提供的最低限度的能量,依據圖象能量關系可知,逆反應的活化能=正反應的活化能+反應的焓變;H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,該反應的活化能為167.2kJ•mol-1,則其逆反應的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol;
故答案為:409.0KJ/mol;
(3)對于同一反應,圖中虛線( II)與實線( I)相比,活化能大大降低,活化分子的百分數增多,反應速率加快,說明反應的活化能降低焓變不變,平衡不動,化學反應速率影響因素中,催化劑有此作用,所以最有可能使用了催化劑;故答案為:最有可能使用了催化劑;
(1)放熱;需要;E2-E1;(2)409.0KJ/mol;(3)使用催化劑.
II.反應熱△H=反應物總鍵能-生成物總鍵能,所以對于S(s)+3F2(g)═SF6(g),其反應熱△H=280kJ/mol+3×160kJ/mol-6×330kJ/mol=-1220kJ/mol,
故答案為:-1220kJ/mol.
點評 本題考查了化學反應的能量變化與反應的焓變關系的分析判斷,反應活化能的判斷計算,圖象的綜合應用,讀懂圖象,焓變和活化能計算方法的理解是解題關鍵.


 怎樣學好牛津英語系列答案
怎樣學好牛津英語系列答案 導學教程高中新課標系列答案
導學教程高中新課標系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在相同條件下:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ/mol | |
| B. | 1 mol石墨不完全燃燒,生成CO2和CO混合氣體時,放熱504.0 kJ | |
| C. | 在相同條件下,C(石墨,s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol | |
| D. | 已知金剛石不如石墨穩定,則石墨轉變為金剛石需要放熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2010年亞運會在我國廣州成功舉辦,整個亞運會體現了環保理念.
2010年亞運會在我國廣州成功舉辦,整個亞運會體現了環保理念.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)分解反應平衡常數和水解反應速率的測定.
某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)分解反應平衡常數和水解反應速率的測定.| 溫度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 橙花醛不能與Br2發生加成反應 | |
| B. | 橙花醛能發生銀鏡反應 | |
| C. | 1 mol橙花醛最多可以與2 mol H2發生加成反應 | |
| D. | 橙花醛是乙烯的同系物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
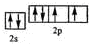 ,該元素的名稱是氧;
,該元素的名稱是氧;查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
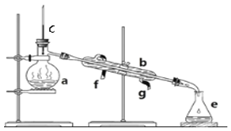 掌握儀器名稱、組裝及使用方法是中學化學實驗的基礎,如圖為實驗裝置.
掌握儀器名稱、組裝及使用方法是中學化學實驗的基礎,如圖為實驗裝置.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 ;
;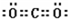 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.93g | B. | 3.51g | C. | 4.00g | D. | 5.85g |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com