
【題目】下列敘述中,正確的是( )
A.在船舶的外殼裝上鋅塊可防止其發生電化學腐蝕,叫作外加電流的陰極保護法.
B.濃硫酸具有吸水性,因此可用作干燥劑,能干燥氫氣、硫化氫、氨氣等氣體
C.FeCl3溶液加熱蒸干、灼燒得到Fe2O3
D.用惰性電極分別電解CuCl2溶液和MgCl2溶液分別得到單質Cu和Mg
科目:高中化學 來源: 題型:
【題目】甲、乙是兩種常見短周期元素的單質,有關物質的轉化關系如圖所示。下列有關說法,錯誤的是( )
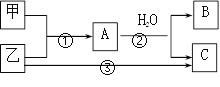
A. 若C為酸性氣體,則B可能具有兩性
B. 若C是堿性氣體,則B一定是堿
C. 若B、C是兩種酸,則B、C一定都是一元酸
D. 以上3個轉變可能都是氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是 ( )
A.某物質的溶液中由水電離出的c(H+)=1×10-amol/L,若a>7時,則該溶液的pH一定為14-a
B.相同物質的量濃度的下列溶液中,①NH4Al(SO4)2、②(NH4)2SO4、③CH3COONH4、④NH3·H2O;c(NH4+)由大到小的順序是:②>①>③>④
C.物質的量濃度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2―)+c(HS―)+c(OH―)
D.AgCl懸濁液中存在平衡:AgCl(s)![]() Ag+(aq)+Cl―(aq),往其中加入少量NaCl粉末,平衡會向左移動,Ksp減少
Ag+(aq)+Cl―(aq),往其中加入少量NaCl粉末,平衡會向左移動,Ksp減少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值。下列說法正確的是( )
A.一定條件下,0.2 mol SO2與足量O2充分反應,生成SO3分子數為0.2NA
B.0.1 mol —NH2(氨基)中含有的電子數為0.7NA
C.3.4 g H2O2中含有的共用電子對數為0.1NA
D.常溫常壓下,16 g O2和O3混合氣體含有的氧原子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】假設一個蛋白質分子由兩條肽鏈共500個氨基酸分子組成,則此蛋白質分子中-COOH數目至少為
A. 502個 B. 500個 C. 2個 D. 1個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是A、B、C、D、E五種有機物的有關信息:
A | B | C | D | E |
①能使溴水褪色 ②比例模型為
③能與水在一定條件下反應生成物質C | ①由C、H兩種元素組成 ②球棍模型為
| ①由C、H、O三種元素組成 ②能與Na反應,但不能與NaOH溶液反應 ③能與E反應生成相對分子質量為100的酯 | ①相對分子質量 比物質C小2 ②能由物質C氧 化而成 | ①由C、H、O三種元素組成 ②球棍模型為
|
根據表中信息回答下列問題:
(1)A與水在一定條件下反應生成的物質C是 (填名稱);寫出在一定條件下,A生成高分子化合物的化學方程式: 。
(2)A與氫氣發生加成反應后生成分子F,與F在分子組成和結構上相似的有機物有一大類(俗稱“同系物”),它們均符合通式 。當n= 時,這類有機物開始出現同分異構體。
(3)B具有的性質是 (填序號)。
①無色無味液體 ②有毒 ③不溶于水 ④密度比水大 ⑤任何條件下不與氫氣反應 ⑥可使酸性高錳酸鉀溶液和溴水均褪色
寫出在濃硫酸作用下,B與濃硝酸反應的化學方程式: 。
(4)寫出由C氧化生成D的化學方程式: 。
(5)C與E反應能生成相對分子質量為100的酯,該反應類型為 ; 其化學方程式為: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2、CO、CO2、NOx是對環境影響較大的幾種氣體,對它們的合理控制和治理是優化我們生存環境的有效途徑。
(1)利用電化學原理將CO、SO2轉化為重要化工原料,裝置如圖所示:

①若A為CO,B為H2,C為CH3OH,則通入CO的一極電極反應式 。
②若A為SO2,B為O2,C為H2SO4,則負極的電極反應式為 。
③若A為NO2,B為O2,C為HNO3,則負極的電極反應式為 。
(2)碳酸鹽燃料電池,以一定比例Li2CO3和Na2CO3低熔混合物為電解質,操作溫度為650 ℃,在此溫度下以鎳為催化劑,以煤氣(CO、H2的體積比為1∶1)直接做燃料,其工作原理如圖所示。
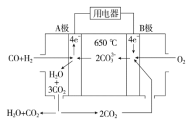
①電池負極反應式為 。
②以此電源電解足量的硝酸銀溶液,若陰極產物的質量為21.6 g,則陽極產生氣體標準況下體積為 L。電解后溶液體積為2 L,溶液的pH約為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來燃煤脫硫技術受到各界科研人員的重視,某脫硫技術涉及如下反應:
Ⅰ. CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ· mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ· mol-1
Ⅱ. CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) ΔH2=-394.0 kJ· mol-1
CaS(s)+3CO2(g) ΔH2=-394.0 kJ· mol-1
(1) 若用K1、K2分別表示反應Ⅰ、Ⅱ的化學平衡常數,則反應![]() CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g)![]()
![]() CaS(s)+2CO2(g)的平衡常數K= (用含K1、K2的式子表示)。
CaS(s)+2CO2(g)的平衡常數K= (用含K1、K2的式子表示)。
(2) 某科研小組研究在其他條件不變的情況下,改變起始一氧化碳物質的量對反應Ⅱ的影響,實驗結果如右圖所示(圖中T表示溫度)。
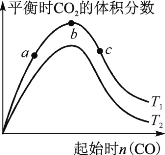
比較在a、b、c三點所處的平衡狀態中,反應物SO2的轉化率最高的是 。
②圖像中T2 (填“高于”、“低于”、“等于”或“無法確定”)T1,判斷的理由是 。
(3)反應3X+Y![]() 2Z在2 min達到平衡后的t1~t6內反應速率與反應時間圖像如圖,在每一時刻均改變一個影響反應速率的因素,則( )
2Z在2 min達到平衡后的t1~t6內反應速率與反應時間圖像如圖,在每一時刻均改變一個影響反應速率的因素,則( )

A.在t1時增大了壓強 B.在t3時加入了催化劑
C.在t4時降低了溫度 D.t2~t3時A的轉化率最高
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com