
(8分)黃銅礦的主要成分X是由Cu、Fe、S三種元素組成的復鹽,其中Cu、Fe兩種元素的質量比為8∶7;將m g X粉末全部溶于200 mL的濃HNO3,反應后的溶液加水稀至 2.12 L時測得其pH=0;將稀釋后的溶液分為兩等份,向其中一份溶液中滴加濃度為6. 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,兩溶液中均生成沉淀,且沉淀的質量隨所加溶
05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,兩溶液中均生成沉淀,且沉淀的質量隨所加溶 液的體積變化如下圖所示:
液的體積變化如下圖所示:
(1)請通過計算確定:m=________。
(2)X的摩爾質量為368 g/mol,則X的化學式為________________。
(3)將一定質量的Fe、Cu的混合物平均分成四等份,每份13.2 g,分別加入同濃度的稀硝酸 ,充分反應后,在標準狀況下生成NO的體積與剩余金屬的質量見下表(設硝酸的還原產物只有NO):
,充分反應后,在標準狀況下生成NO的體積與剩余金屬的質量見下表(設硝酸的還原產物只有NO):
| 實驗編號 | ① | ② | ③ | ④ |
| 稀硝酸體積/mL | 100 | 200 | 300 | 400 |
| 剩余金屬質量/g | 9.0 | 4.8 | 0 | 0 |
| NO體積/L | 1.12 | 2.24 | 3.36 | V |
(8分)
(1)解:依題意,m g X中:n(Cu)∶n(F e)=1∶1
e)=1∶1
2n(Cu2+)+3n(Fe3+)=6.05mol·L-1×0.2 L×2-1 mol·L-1×2.12 L
故:n(Cu)=n(Fe)=0.06 mol
又,n (S)=0.6 mol·L-1×0.1 L×2 = 0.12 mol
因此:m g=m(Cu)+m(Fe)+m(S)=0.06 mol×64g·mol-1+0.06 mol×56 g·mol-1+0.12 mol×32 g·mol-1=11.04 g( 即m 的值為11.04)
(2)解:設X的化學式為(CuFeS2)n,則 (64+56+32×2)×n =3 68,n=2;故X的化學式為Cu2Fe2S4
68,n=2;故X的化學式為Cu2Fe2S4
(3)① 3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O ② V=4.48 L
解析


科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
Ⅰ.實驗表明,CuO被H2還原時也有Cu2O生成。將一定量的H2緩慢通過灼熱的CuO粉末,得到固體混合物且混合物中m(Cu)∶m(O)=8∶a。當a有不同的取值時,固體混合物成分不同。請分析a的取值范圍和固體混合物成分的關系并填入下表(不一定填滿,表格不夠也可自行增加):
a的取值范圍 | 反應后固體的成分(用化學式表示) |
|
|
|
|
|
|
Ⅱ.黃銅礦的主要成分X是由Cu、Fe、S三種元素組成的復鹽,其中Cu、Fe兩種元素的質量比為8∶7;將m g X粉末全部溶于200 mL的濃HNO3,反應后的溶液加水稀釋至2.12 L時測得其pH為0;將稀釋后的溶液分為兩等份,向其中一份溶液中滴加6.05 mol·L-1的NaOH溶液,向另一份溶液中滴加0.600 mol·L-1 Ba(NO3)2溶液,兩溶液中均生成沉淀,且沉淀的質量隨所加溶液的體積變化如下圖所示:
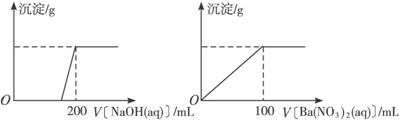
(1)請通過計算確定m值。
(2)X的摩爾質量為368 g·mol-1,請確定X的化學式。
查看答案和解析>>
科目:高中化學 來源: 題型:
(8分)黃銅礦的主要成分X是由Cu、Fe、S三種元素組成的復鹽,其中Cu、Fe兩種元素的質量比為8∶7;將m g X粉末全部溶于200 mL的濃HNO3,反應后的溶液加水稀至 2.12 L時測得其pH=0;將稀釋后的溶液分為兩等份,向其中一份溶液中滴加濃度為6. 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/L Ba(NO3)2溶液,兩溶液中均生成沉淀,且沉淀的質量隨所加溶液的體積變化如下圖所示:
(1)請通過計算確定:m=________。
(2)X的摩爾質量為368 g/mol,則X的化學式為________________。
(3)將一定質量的Fe、Cu的混合物平均分成四等份,每份13.2 g,分別加入同濃度的稀硝酸,充分反應后,在標準狀況下生成NO的體積與剩余金屬的質量見下表(設硝酸的還原產物只有NO):
| 實驗編號 | ① | ② | ③ | ④ |
| 稀硝酸體積/mL | 100 | 200 | 300 | 400 |
| 剩余金屬質量/g | 9.0 | 4.8 | 0 | 0 |
| NO體積/L | 1.12 | 2.24 | 3.36 | V |
回答下列問題:
①寫出實驗①中發生反應的離子方程式___________________________________。
②實驗④中V=________。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年河南省南陽市高三9月月考理科綜合化學試卷(解析版) 題型:計算題
(16分). 銅是人類最早知道的金屬之一,實驗室可用C、H2還原CuO制取少量的Cu,工業上主要用火法從黃銅礦中提煉Cu。
Ⅰ. 實驗證明,C還原CuO時既可能生成Cu,也可能生成Cu2O,即使在C過量時,實驗中CuO也可能部分未被還原。為了測定某次實驗產物的組成,取1.2 g C跟8.0 g CuO混合加熱,將反應生成的氣體通過足量的澄清石灰水并集氣。一段時間后停止加熱,共收集到560 mL氣體(已經折算成標準狀況),測得沉淀的質量為2.5 g。則:
(1)上述實驗中C (填“完全”或“不完全”)參加反應,實驗中收集到的氣
體是 (填寫化學式),產生這種氣體的化學方程式為: 。
(2) 反應后得到的固體混合物總質量為 ,其中含氧化合物的物質的量為 mol。
Ⅱ. 黃銅礦的主要成分X是由Cu、Fe、S三種元素組成的復鹽,其中Cu、Fe兩種元素的質量比為8∶7;將m g X粉末全部溶于200 mL的濃HNO3,反應后的溶液加水稀釋至 2.12 L時測得其pH為0;將稀釋后的溶液分為兩等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO3)2溶液,兩溶液中均生成沉淀,且沉淀的質量隨所加溶液的體積變化如下圖所示:
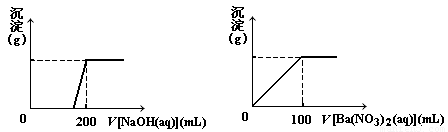
(1) 請通過計算確定m的值;
(2) X的摩爾質量為368 g/mol,請確定X的化學式。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com