【答案】
分析:A、漂白粉溶液在空氣中失效時,生成的是碳酸鹽而不是碳酸氫鹽,此外2HClO
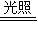
2HCl+O
2↑,沒有這一步關鍵反應就不叫漂白粉失效;
B、離子方程式的書寫要遵循電荷守恒;
C、金屬氧化物和強酸(非氧化性)反應生成對應的鹽和水;
D、碘離子有強還原性,雙氧水在酸性環境下具有氧化性,二者之間發生氧化還原反應.
解答:解:A、漂白粉溶液在空氣中失效的離子方程式為:ClO
-+CO
2+H
2O═HClO+CO
32-,此外2HClO
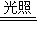
2HCl+O
2↑,沒有這一步關鍵反應就不叫漂白粉失效;故A錯誤;
B、用濃鹽酸與MnO
2反應制取少量氯氣的離子方程式為:MnO
2+4H
++2Cl
-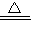
Mn
2++Cl
2↑+2H
2O,故B錯誤;
C、將Fe
2O
3溶解于足量H
+溶液,氧化物溶解得到對應的鹽和水,方程式為:Fe
2O
3+6H
+=2Fe
3++3H
2O,故C正確;
D、碘離子有強還原性,雙氧水在酸性環境下具有氧化性,反應的離子方程式為:2I
-+H
2O
2+2H
+=2H
2O+I
2,故D正確.
故選CD.
點評:本題主要考查學生離子方程式的正誤判斷方法,是現在考試的熱點,難度不大.

 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O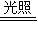 2HCl+O2↑,沒有這一步關鍵反應就不叫漂白粉失效;
2HCl+O2↑,沒有這一步關鍵反應就不叫漂白粉失效; 2HCl+O2↑,沒有這一步關鍵反應就不叫漂白粉失效;故A錯誤;
2HCl+O2↑,沒有這一步關鍵反應就不叫漂白粉失效;故A錯誤;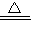 Mn2++Cl2↑+2H2O,故B錯誤;
Mn2++Cl2↑+2H2O,故B錯誤;
